题目内容
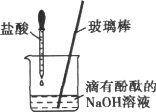
【题目】(7分)某化学实验小组在做盐跟盐反应的分组实验时,第一组同学进行BaCl2与Na2CO3溶液的反应,第二组同学进行BaCl2与Na2SO4溶液的反应。实验结束后,两组同学将试管内全部的物质集中倒进一个废液缸中。将废液缸中的物质进行过滤,得到滤液和沉淀。化学兴趣小组同学要探究得到的滤液中溶质的成分。
【提出问题】滤液里含有什么溶质?
【提出猜想】猜想①: ;
猜想②:NaCl、Na2SO4 ;
猜想③:NaCl、Na2CO3 ;
猜想④:NaCl、Na2CO3、Na2SO4 ;
猜想⑤:NaCl
【实验探究】
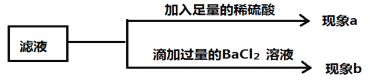
(1)观察到现象a:只有气泡产生,则小组同学认为猜想③成立,他们的结论是否正确?
请说明理由 ;
(2)向滤液中加入过量BaCl2溶液,若产生的现象b为:生成白色沉淀,然后加入足量的稀硝酸沉淀完全溶解,有气泡产生,则猜想____ 成立,上述实验过程中发生的反应的化学方程式为 ;若猜想④成立,则上述实验过程加入足量稀硝酸后观察到的现象为 。
(3)经过讨论,小组同学一致认为猜想③成立。要把废液变为中性才能排放,应如何处理废液 。
【答案】NaCl BaCl2
(1)不正确,加入稀硫酸产生气泡,证明滤液中有Na2CO3 ,但无法确定是否含有Na2SO4
(2)③ BaCl2 + Na2CO3 == 2NaCl + BaCO3↓ BaCO3 + 2HNO3 == Ba(NO3)2 + CO2↑ + H2O ;
固体表面有气泡,固体减少但不消失(或白色固体部分消失)
(3)加入适量的稀盐酸至溶液呈中性排放
【解析】
试题分析:
【提出猜想】碳酸钠与氯化钡反应生成的是碳酸钡沉淀和氯化钠;氯化钡与硫酸钠反应生成的是硫酸钡沉淀和氯化钠。考虑到反应物是否过量的问题,故反应后的溶液中溶质可能存在以下几种情况:只有氯化钠;氯化钠和碳酸钠;氯化钠和硫酸钠;氯化钠、碳酸钠和硫酸钠;氯化钠、氯化钡;
【实验探究】
(1)有气泡产生,说明溶液中一定含有碳酸钠,但不能确定是否含有硫酸钠;
(2)加入足量的稀硝酸沉淀完全溶解,说明生成的碳酸钡沉淀,即溶液中含有碳酸钠,不能硫酸钠,说明猜想3正确;
(3)碳酸钠溶液呈碱性,可加入适量的酸如稀盐酸使它们反应生成中性的氯化钠溶液再排放。