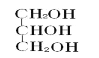题目内容
【题目】某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢.水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量浓度为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.
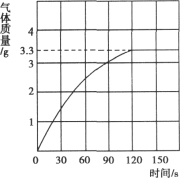
(1)从图中可以看出,10g水垢与盐酸反应后生成的二氧化碳最多是________g.
(2)水垢中碳酸钙的质量分数是多少?
(3)假设水垢中除碳酸钙和氢氧化镁外,不含有其他杂质,溶解10g水垢,至少需要溶质质量分数为10%的盐酸的质量是多少?(最后结果保留一位小数)
【答案】(1)3.3
(2)![]()
(3)86.2g
【解析】解答本题的关键是从图像中读出生成二氧化碳的质量,根据二氧化碳的质量求出CaCO3的质量和CaCO3消耗的HCl的质量,然后求出Mg(OH)2的质量,根据Mg(OH)2与盐酸反应的化学方程式求出Mg(OH)2消耗HCl的质量,最后求出一共消耗盐酸的质量.
(1)3.3
(2)解:设碳酸钙的质量为x,与碳酸钙反应的盐酸中溶质的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 3.3g
![]()
![]()
解得:x=7.5g y=5.475g
则水垢中碳酸钙的质量分数为![]() .
.
(3)10g水垢中氢氧化镁的质量为10g-7.5g=2.5g
设与2.5g氢氧化镁完全反应所需的HCl的质量为z.
2HCl+Mg(OH)2=MgCl2+2H2O
73 58
z 2.5g
![]()
解得:z=3.147g
则10g水垢一共消耗盐酸的质量为(3.147g+5.475g)÷10%=86.2g
答:略.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目