题目内容
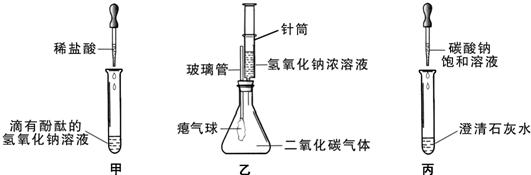
35、同学们在学习碱的化学性质时,进行了如图所示的实验.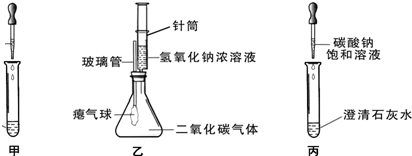
(1)甲实验中,在用稀盐酸和氢氧化钠溶液进行中和反应实验时,溶液的酸碱度变化如图所示.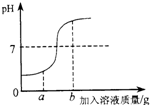
①该实验操作是将
②当加入溶液的质量为ag时,所得溶液中的溶质为(写化学式)
③当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是
(3)丙实验中观察到的现象是

(1)甲实验中,在用稀盐酸和氢氧化钠溶液进行中和反应实验时,溶液的酸碱度变化如图所示.

①该实验操作是将
氢氧化钠
溶液滴加到另一种溶液中.②当加入溶液的质量为ag时,所得溶液中的溶质为(写化学式)
NaCl和HCl
.③当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈
红
色.(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是
气球胀大
.(3)丙实验中观察到的现象是
产生白色沉淀
.分析:(1)由图象可知溶液的PH开始小于7,随溶液的加入PH在不断变大,且由图象可知在加入ag溶液时PH<7,说明酸过量来分析反应后溶液中的溶质,而加入bg溶液时PH>7,则说明溶液显碱性,来分析所得溶液中滴加酚酞溶液的颜色变化.
(2)利用氢氧化钠溶液与二氧化碳反应,使锥形瓶内气体减少来分析现象;
(3)根据碳酸钠溶液和澄清石灰水的反应来分析反应的现象.
(2)利用氢氧化钠溶液与二氧化碳反应,使锥形瓶内气体减少来分析现象;
(3)根据碳酸钠溶液和澄清石灰水的反应来分析反应的现象.
解答:解:(1)①由图可知,开始溶液的PH<7,然后随某溶液的加入PH在逐渐变大,则说明是将氢氧化钠溶液滴加到盐酸中,故答案为:氢氧化钠;
②结合图象可知,当加入氢氧化钠溶液的质量为ag时,PH<7,则说明酸过量,盐酸与氢氧化钠反应生成氯化钠,且有剩余的盐酸,即反应后溶液中的溶质为NaCl和HCl,
故答案为:NaCl和HCl;
③由图可知,当加入氢氧化钠溶液的质量为bg时,溶液的PH>7,说明碱过量,则向所得溶液中滴加酚酞溶液,溶液变红,故答案为:红;
(2)乙实验中由氢氧化钠与二氧化碳反应可知,锥形瓶内气体减少,而外压不变,则将使瘪气球变大,故答案为:气球胀大;
(3)因碳酸钠溶液与澄清石灰水反应生成不溶于水的碳酸钙沉淀,则可观察到有白色沉淀生成,故答案为:产生白色沉淀.
②结合图象可知,当加入氢氧化钠溶液的质量为ag时,PH<7,则说明酸过量,盐酸与氢氧化钠反应生成氯化钠,且有剩余的盐酸,即反应后溶液中的溶质为NaCl和HCl,
故答案为:NaCl和HCl;
③由图可知,当加入氢氧化钠溶液的质量为bg时,溶液的PH>7,说明碱过量,则向所得溶液中滴加酚酞溶液,溶液变红,故答案为:红;
(2)乙实验中由氢氧化钠与二氧化碳反应可知,锥形瓶内气体减少,而外压不变,则将使瘪气球变大,故答案为:气球胀大;
(3)因碳酸钠溶液与澄清石灰水反应生成不溶于水的碳酸钙沉淀,则可观察到有白色沉淀生成,故答案为:产生白色沉淀.
点评:本题考查了碱的化学性质,学生应熟悉碱的通性,并能利用信息结合碱的性质来解决问题,(1)中反应与图象相结合,明确图象中曲线的变化是解答的关键.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目