题目内容
【题目】某化学兴趣小组的同学在学习九年级《化学》下册中的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的碳酸钙当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O═Ca(HCO3)2。
【提出问题】向NaOH溶液里通入一定量CO2 , 反应后的溶质组成是什么?
【查阅资料】
(1)在NaOH溶液中通入少量CO2反应的化学方程式:。
(2)在NaOH溶液中通入过量CO2 , 反应的化学方程式为:
2NaOH+CO2+H2O═2NaHCO3 .
碳酸氢钠溶液呈碱性.
【提出猜想】猜想一:溶质为Na2CO3; 猜想二:溶质为NaHCO3;
猜想三:溶质为(填化学式).
(3)【设计实验】
实验步骤 | 实验现象 | 实验结论 |
①取反应后溶液少许于试管中,向其中滴加几滴酚酞 | 酚酞变红色 | 该溶液显碱性 |
②另取反应后溶液少许于试管中,向其中滴加过量的CaCl2溶液 | 有生成。 | 猜想二不成立 |
③取步骤②中的上层清液,滴入稀盐酸 | 有气泡冒出,化学方程式为 | 猜想一不成立 |
【得出结论】猜想三成立.
(4)【讨论交流】有同学提出,实验步骤①是多余的,理由是。
(5)【反思应用】同学们回忆起实验室检验二氧化碳的情景,如果向澄清石灰水中不断通入二氧化碳,会看到现象,此时下列哪一种曲线能反映出该溶液的导电性与二氧化碳的量之间的关系
【答案】
(1)CO2+2NaOH=Na2CO3+H2O
(2)Na2CO3和NaHCO3
(3)白色沉淀,Na2CO3+2HCl=2NaCl+H2O+CO2↑
(4)碳酸氢钠和碳酸钠都是碱性的
(5)溶液由澄清变浑浊 又由浑浊变澄清,C
【解析】
【查阅资料】(1)在NaOH溶液中通入少量CO2反应生成的碳酸钠和水,故化学方程式是:CO2+2NaOH=Na2CO3+H2O
(2)由于存在两个反应,故反应的生成物有可能是单一的一种物质,或者是两种物质的混合物,故答案:猜想三:溶质为Na2CO3和NaHCO3。
【设计实验】
①取反应后溶液少许于试管中,向其中滴加几滴酚酞,碳酸氢钠和碳酸钠的溶液都是碱性的,都能使酚酞溶液变红,故加酚酞的步骤没有意义。
②取反应后溶液少许于试管中,向其中滴加过量的CaCl2溶液,发生化学反应:Na2CO3+ CaCl2= CaCO3↓+2 NaCl,NaHCO3与CaCl2溶液不反应。要猜想二成立,就必须有:Na2CO3,有:Na2CO3的现象为有白色沉淀生成;
③在上步实验中,在第②步中滴加过量的CaCl2溶液,已经除尽了Na2CO3,取步骤②中的上层清液,滴入稀盐酸有气泡冒出,说明含有NaHCO3,因为NaHCO3 + HCl = NaCl + H2O + CO2↑。
【讨论交流】碳酸氢钠和碳酸钠的溶液都是碱性的,都能使酚酞溶液变红,次布多余;。
【反思应用】故向澄清石灰水中不断通入二氧化碳,发生的化学反应为:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2。因此会看到溶液由澄清变浑浊又由浑浊变澄清的现象。二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水,随着反应的进行溶液中的能自由移动的离子越来越少,导电性减弱,至恰好完全反应时溶液中没有自由移动的离子,导电能力为0;继续通入二氧化碳,二氧化碳与水反应生成碳酸,碳酸钙与水、二氧化碳反应生成可溶于水的碳酸氢钙,溶液中存在能自由移动的离子,导电性增强.C图能反映出溶液的导电性与二氧化碳的量之间的关系。
【考点精析】关于本题考查的二氧化碳的化学性质,需要了解化学性质:一般情况下不能燃烧,也不支持燃烧,不能供给呼吸;与水反应生成碳酸;能使澄清的石灰水变浑浊;与灼热的碳反应才能得出正确答案.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】反思、归纳与提升是化学学习的重要方法.
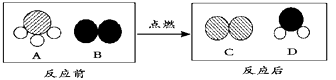
(1)对于复分解反应及其规律,通过反思与探索,同学们有了新的认识. 【探索发现】①氢氧化钠溶液与盐酸反应的微观示意图如图1;
【分析归纳】反应的化学方程式
反应的实质:H++OH﹣═H2O,反应能进行的原因是溶液中的H+和OH﹣的数目减少,即自由移动的离子数目减少.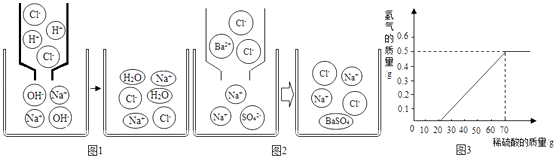
②硫酸钠溶液跟氯化钡溶液反映的微观示意图如图2:
【分析归纳】反应的化学方程式为:Na2SO4+BaCl2═2NaCl+BaSO4↓.反应能进行的原因是溶液中的数目减少,即自由移动的离子数目减少.(提示:生成硫酸钡白色沉淀)
【总结规律】上述复分解反应能发生的本质原因是 .
(2)某同学利用以下几组物质探究硫酸的性质
组合序号 | ① | ② | ③ | ④ | ⑤ |
组合物质 | H2SO4 | H2SO4 | H2SO4 | H2SO4 | H2SO4 |
【记录和解释】待几组物质恰好完全反应后,往溶液中滴加紫色的石蕊溶液,其中组合与另外四组现象不同,请从反应发生的本质角度解释产生不同现象的原因 .
(3)某兴趣小组用10g镁条与溶质质量分数为49%的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其它杂质). ①当稀硫酸的质量为70g,产生的氢气的质量为g.
②用化学方程式说明当稀硫酸的质量为10g时,为什么不产生氢气 .
③计算镁条中镁元素的质量分数(写出计算过程).