��Ŀ����
����Ŀ����˼�������������ǻ�ѧѧϰ����Ҫ������
��1�����ڸ��ֽⷴӦ������ɣ�ͨ����˼��̽����ͬѧ�������µ���ʶ�� ��̽�����֡�������������Һ�����ᷴӦ����ʾ��ͼ��ͼ1��
���������ɡ���Ӧ�Ļ�ѧ����ʽ
��Ӧ��ʵ�ʣ�H++OH���TH2O����Ӧ�ܽ��е�ԭ������Һ�е�H+��OH������Ŀ���٣��������ƶ���������Ŀ���٣�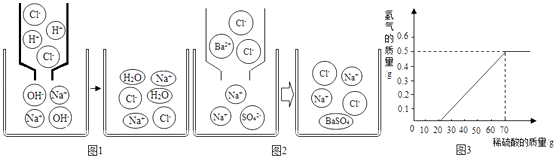
����������Һ���Ȼ�����Һ��ӳ����ʾ��ͼ��ͼ2��
���������ɡ���Ӧ�Ļ�ѧ����ʽΪ��Na2SO4+BaCl2�T2NaCl+BaSO4������Ӧ�ܽ��е�ԭ������Һ������Ŀ���٣��������ƶ���������Ŀ���٣�����ʾ���������ᱵ��ɫ������
���ܽ���ɡ��������ֽⷴӦ�ܷ����ı���ԭ���� ��
��2��ijͬѧ�������¼�������̽�����������
������ | �� | �� | �� | �� | �� |
������� | H2SO4 | H2SO4 | H2SO4 | H2SO4 | H2SO4 |
����¼�ͽ��͡�����������ǡ����ȫ��Ӧ������Һ�еμ���ɫ��ʯ����Һ�����������������������ͬ����ӷ�Ӧ�����ı��ʽǶȽ��Ͳ�����ͬ�����ԭ�� ��
��3��ij��ȤС����10gþ����������������Ϊ49%��ϡ���ᷴӦ����ò���������������ϡ�����������ϵ��ͼ������þ���г����溬������þ�⣬û���������ʣ��� �ٵ�ϡ���������Ϊ70g������������������Ϊg��
���û�ѧ����ʽ˵����ϡ���������Ϊ10gʱ��Ϊʲô���������� ��
�ۼ���þ����þԪ�ص�����������д��������̣���
���𰸡�
��1��NaOH+HCl=NaCl+H2O�������Ӻ���������ӣ���Һ�������ƶ����ӵ���Ŀ����
��2���ݣ��������������е������Ӳμ��˷�Ӧ,��Ϣ�������û�вμӷ�Ӧ
��3��0.5��MgO+H2SO4=MgSO4+H2O�����ݺ�����þ��Ӧ��������20g,����������ʵ��������ݹ�ϵʽ��������þ�е���Ԫ�ص������� ������þ����Ԫ�ص�����Ϊx��MgO+H2SO4=MgSO4+H2O�ɵù�ϵʽΪ
O�������� | H2O�������� | H2SO4 |
16 | 98 | |
x | 20g��49% |
![]() =
= ![]() x=1.6g��þ����þԪ�ص���������Ϊ
x=1.6g��þ����þԪ�ص���������Ϊ ![]() ��100%=84%�����߸���þԪ���غ��þԪ�غ�ϡ���������ʵĹ�ϵʽ��þԪ�ص�����Ϊy
��100%=84%�����߸���þԪ���غ��þԪ�غ�ϡ���������ʵĹ�ϵʽ��þԪ�ص�����Ϊy
Mg���������� | MgSO4������ | H2SO4 |
24 | 98 | |
y | 70g��49% |
![]() =
= ![]() y=8.4g��þ����þԪ�ص���������Ϊ
y=8.4g��þ����þԪ�ص���������Ϊ ![]() ��100%=84%
��100%=84%
���������⣺��1�������������ƺ����ᷴӦ�����Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪNaOH+HCl=NaCl+H2O��
��Ӧ��ʵ�ʣ�H++OH���TH2O����Ӧ�ܽ��е�ԭ������Һ�е�H+��OH������Ŀ���٣��������ƶ���������Ŀ���٣�����������Һ���Ȼ�����Һ��ӳ����ʾ��ͼ�����������ɡ���Ӧ�Ļ�ѧ����ʽΪ��Na2SO4+BaCl2�T2NaCl+BaSO4������Ϣ��з����ķ�Ӧ���е�ԭ��Ľ��ʽ����Ӧ�ܽ��е�ԭ������Һ�б����Ӻ���������ӵ���Ŀ���٣��������ƶ���������Ŀ���٣�
���ܽ���ɡ��������ֽⷴӦ�ܷ����ı���ԭ������Һ�������ƶ����ӵ���Ŀ���٣���2��ijͬѧ�������¼�������̽�����������
����¼�ͽ��͡�����������ǡ����ȫ��Ӧ������Һ�еμ���ɫ��ʯ����Һ������ҺΪ��ɫ������ҺΪ��ɫ������ҺΪ��ɫ������ҺΪ��ɫ������ҺΪ��ɫ��������� ����������������ͬ���٢ڢۢ��п�ʼ�������ӣ��ڷ�Ӧ�������������ӣ�������Һ������ʾ���ԣ�������û�����������ӣ�����������ʾ���ԣ����Է�Ӧ�����ı��ʽǶȽ��Ͳ�����ͬ�����ԭ�����������������е������Ӳμ��˷�Ӧ����Ϣ�������û�вμӷ�Ӧ����3��ij��ȤС����10gþ����������������Ϊ49%��ϡ���ᷴӦ����ò���������������ϡ�����������ϵ��ͼ������þ���г����溬������þ�⣬û���������ʣ�������ͼ���Կ�������ϡ���������Ϊ70g������������������Ϊ 0.5g����þ���г����溬������þ�����Կ�ʼû������Ľ�������þ�����ᷴӦ��������þ��ˮ����Ӧ�Ļ�ѧ����ʽΪ��MgO+H2SO4=MgSO4+H2O��
���Դ��ǣ���1��NaOH+HCl=NaCl+H2O�� �����Ӻ���������ӣ���Һ�������ƶ����ӵ���Ŀ���٣���2���ݣ��������������е������Ӳμ��˷�Ӧ����Ϣ�������û�вμӷ�Ӧ����3����0.5����MgO+H2SO4=MgSO4+H2O����84%
�����㾫�����������⣬������Ҫ�˽���ݻ�ѧ��Ӧ����ʽ�ļ���(�����ʼ�������=ϵ������Է�������֮��)��

����Ŀ��ij��ѧ��ȤС���ͬѧ��ѧϰ���꼶����ѧ���²��е����Ͽ�Ƭ��ʯ�������ʯ���γɡ�ʱ������������ˮ��̼��Ƶ��������ж�����̼��ˮʱ���ᷴӦ�����ܽ��Խϴ��̼����ƣ�CaCO3��CO2��H2O�TCa(HCO3)2��
��������⡿��NaOH��Һ��ͨ��һ����CO2 �� ��Ӧ������������ʲô��
���������ϡ�
��1����NaOH��Һ��ͨ������CO2��Ӧ�Ļ�ѧ����ʽ����
��2����NaOH��Һ��ͨ�����CO2 �� ��Ӧ�Ļ�ѧ����ʽΪ��
2NaOH��CO2��H2O�T2NaHCO3 ��
̼��������Һ�ʼ��ԣ�
��������롿����һ������ΪNa2CO3�� �����������ΪNaHCO3��
������������Ϊ���ѧʽ����
��3�������ʵ�顿
ʵ�鲽�� | ʵ������ | ʵ����� |
��ȡ��Ӧ����Һ�������Թ��У������еμӼ��η�̪ | ��̪���ɫ | ����Һ�Լ��� |
����ȡ��Ӧ����Һ�������Թ��У������еμӹ�����CaCl2��Һ | �����ɡ� | ����������� |
��ȡ������е��ϲ���Һ������ϡ���� | ������ð������ѧ����ʽΪ | ����һ������ |
���ó����ۡ�������������
��4�������۽�������ͬѧ�����ʵ�鲽����Ƕ���ģ���������
��5������˼Ӧ�á�ͬѧ�ǻ�����ʵ���Ҽ��������̼���龰����������ʯ��ˮ�в���ͨ�������̼���ῴ������ʱ������һ�������ܷ�ӳ������Һ�ĵ������������̼����֮��Ĺ�ϵ