题目内容
20、实验室用密度为1.84g/cm3的浓硫酸,配制500g质量分数为20%的稀硫酸.欲计算所需浓硫酸的体积,你认为下列说法中正确的是( )
分析:根据配制溶液时溶质的质量不变可以得到:m1×ω1%═m2×ω2%,而浓硫酸的质量等于密度与体积的乘积.
解答:解:浓硫酸配制稀硫酸,需加水稀释,但溶质硫酸的质量不变,根据m1×ω1%═m2×ω2%,得:
500g×20%═1.84g/cm3×V×ω2%,则可以看出要求浓硫酸的体积,还要知道密度为1.84g/cm3的浓硫酸的溶质质量分数.
A中水的密度不需要知道,等式中与水无关,故A错误.
B中稀硫酸的质量已知,不需要知道稀硫酸的密度,故B错误.
C中根据等式可以看出浓硫酸的体积,还需知道质量分数,故C正确.
D中根据等式可以看出条件不足,无法求体积,故D错误.
故选C.
500g×20%═1.84g/cm3×V×ω2%,则可以看出要求浓硫酸的体积,还要知道密度为1.84g/cm3的浓硫酸的溶质质量分数.
A中水的密度不需要知道,等式中与水无关,故A错误.
B中稀硫酸的质量已知,不需要知道稀硫酸的密度,故B错误.
C中根据等式可以看出浓硫酸的体积,还需知道质量分数,故C正确.
D中根据等式可以看出条件不足,无法求体积,故D错误.
故选C.
点评:学生应能理解在稀释溶液的过程中变化的量和不变的量,善于根据等式来分析解答问题.

练习册系列答案
相关题目
| |||||||||||||||||||||||||||
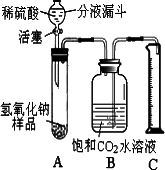
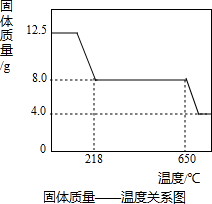 某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).
某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).

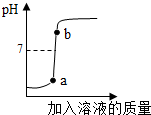 (2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.
(2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.