题目内容
攀登珠穆朗玛峰活动中,假如每名运动员冲顶时消耗自带的液氧4.8㎏.求:
(1)这些氧气在标准状况下的体积是多少L?(标准状况下氧气密度为1.43g/L)
(2)若在实验室用高锰酸钾为原料制取相同质量的氧气(化学方程式为2KMnO4
K2MnO4+MnO2+O2↑),需要多少㎏高锰酸钾?
(3)简述用(2)中的方法给登山队员供氧是否可行?
(1)这些氧气在标准状况下的体积是多少L?(标准状况下氧气密度为1.43g/L)
(2)若在实验室用高锰酸钾为原料制取相同质量的氧气(化学方程式为2KMnO4
| ||
(3)简述用(2)中的方法给登山队员供氧是否可行?
分析:(1)根据物理上所学的密度公式可以计算出氧气的体积;
(2)根据高锰酸钾分解的化学方程式和所需氧气的质量,列出比例式,就可计算出需要高锰酸钾的质量.
(3)根据实际运动过程和实验操作分析即可.
(2)根据高锰酸钾分解的化学方程式和所需氧气的质量,列出比例式,就可计算出需要高锰酸钾的质量.
(3)根据实际运动过程和实验操作分析即可.
解答:解:(1)4.8kg=4.8×103g
所以V(O2)=
=3.36×103L
(2)设需要高锰酸钾的质量为x,则有
2KMnO4
K2MnO4+MnO2+O2↑
316 32
x 4.8kg
=
解之得:x=47.4kg
(3)不能用这种方法给登山队员供氧,高锰酸钾的质量太大不能携带且成本太高,经济上不合算.
答:(1)这些氧气在标准状况下的体积是3.36×103L;
(2)需要47.4㎏高锰酸钾;
(3)不能用这种方法给登山队员供氧,高锰酸钾的质量太大不能携带且成本太高,经济上不合算.
所以V(O2)=
| 4.8×103g |
| 1.43g/L |
(2)设需要高锰酸钾的质量为x,则有
2KMnO4
| ||
316 32
x 4.8kg
| 316 |
| x |
| 32 |
| 4.8kg |
解之得:x=47.4kg
(3)不能用这种方法给登山队员供氧,高锰酸钾的质量太大不能携带且成本太高,经济上不合算.
答:(1)这些氧气在标准状况下的体积是3.36×103L;
(2)需要47.4㎏高锰酸钾;
(3)不能用这种方法给登山队员供氧,高锰酸钾的质量太大不能携带且成本太高,经济上不合算.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
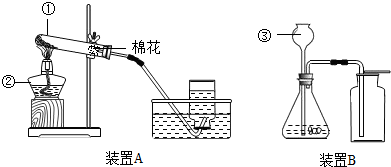
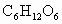 )是人体中重要的糖类物质之一,在人体组织里,它能在酶的作用下经缓慢氧化转变成二氧化碳和水,同时放出能量,供人体活动所需和维持恒定体温.请写出反应的化学方程式________.
)是人体中重要的糖类物质之一,在人体组织里,它能在酶的作用下经缓慢氧化转变成二氧化碳和水,同时放出能量,供人体活动所需和维持恒定体温.请写出反应的化学方程式________. )是人体中重要的糖类物质之一,在人体组织里,它能在酶的作用下经缓慢氧化转变成二氧化碳和水,同时放出能量,供人体活动所需和维持恒定体温.请写出反应的化学方程式________.
)是人体中重要的糖类物质之一,在人体组织里,它能在酶的作用下经缓慢氧化转变成二氧化碳和水,同时放出能量,供人体活动所需和维持恒定体温.请写出反应的化学方程式________. K2MnO4+MnO2+O2↑),需要多少㎏高锰酸钾?
K2MnO4+MnO2+O2↑),需要多少㎏高锰酸钾?