题目内容
 某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).
某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).Ⅰ、硫酸铜的制备
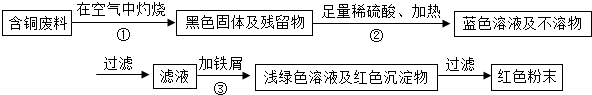
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:

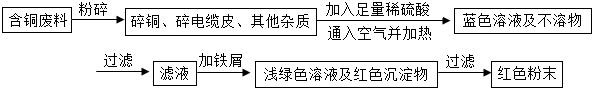
方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:

(1)上述方案中的①、②、③三处,与铜或铜的化合物有关的化学反应方程式分别是:
①
(2)从环保角度对两套方案的不同部分进行比较,你认为方案
(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的原因为
(4)若上述方案所用的稀硫酸溶质质量分数为36.8%,问每1L98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸
(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体.晶体采用酒精淋洗的优点是
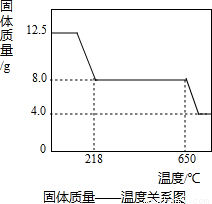
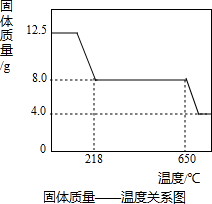
Ⅱ、硫酸铜晶体(CuSO4?xH2O)中结晶水(xH2O)含量的测定:在老师的指导下,学习小组取12.5g硫酸铜晶体(CuSO4?xH2O)进行热分解,获得相关数据,并绘制成固体质量-温度的关系如下图.
(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为
(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
(3)根据图中数据,计算CuSO4?xH2O中x的值为
(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:
Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为
分析:“从含铜废料中回收铜”符合绿色化学的理念,再回收利用中,设计了两套方案,处理有关问题,并进行评价.甲方案中:发生的有关化学方程式为:①2Cu+O2
2CuO;②CuO+H2SO4═CuSO4+H2O;③Fe+CuSO4═FeSO4+Cu.但“灼烧”会产生污染空气的气体、粉尘、烟雾,所以不如乙方案更合理;然后设计提取的有关问题;最后考查学生的计算能力及体验回收成果,增强成就感.
| ||
解答:解:Ⅰ、(1)铜在空气中灼烧生成黑色固体氧化铜,氧化铜与硫酸反应生成蓝色硫酸铜,与铁屑反应置换出铜,反应方程式为:2Cu+O2
2CuO;
CuO+H2SO4═CuSO4+H2O; Fe+CuSO4═FeSO4+Cu;
(2)从环保角度对两套方案的不同部分进行比较,甲方案第一步灼烧会产生污染空气的气体,粉尘,烟雾,由此可知方案2更合理;
(3)H2O2受热易分解,温度应该控制在50℃到60℃之间;
(4)设稀硫酸的质量为x,则36.8%x=1000mL×1.84g/mL×98%,得x=4900g;需要水的体积:(4900g-1000mL×1.84g/mL)÷1.0g/mL=3060mL,即3.06L.
稀释浓硫酸的方法是:将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌.
(5)硫酸铜晶体易溶于水,用少量95%的酒精淋洗后晾干,为的是减少硫酸铜晶体因溶于水而损失.
Ⅱ、(1)硫酸铜晶体(CuSO4?xH2O)是蓝色的,失去结晶水后变为白色;
(2)根据题意写出化学方程式:2CuSO4
2CuO+2SO2↑+O2↑;
(3)由图示数据和“到t1℃时该固体完全失去结晶水”可知,结晶水的质量为:12.50g-8.0g=4.5g
CuSO4?xH2O
CuSO4+xH2O↑.
160+18x 18x
12.50g 4.5g
∴
=
∴160+18x=50x,
∴x=
=5;
CuSO4?5H2O的CuSO4的质量分数
×100%=64%
)4.0g剩余固体继续加热到更高的温度,说明生成的氧化铜分解了,化学方程式为:4CuO
2Cu2O+O2↑.
Ⅲ、Cu4(OH)6SO4中OH化合价为-1,SO4的化合价为-2,根据化合物中正负化合价的代数和为0,可得铜元素的化合价为+2;
Cu4(OH)6SO4可以写成盐和碱的形式为CuSO4?3Cu(OH)2;Cu2+是重金属使蛋白质失去活性,这说明病原菌的主体是蛋白质.
故答案为:
Ⅰ(1)①2Cu+O2
2CuO;②CuO+H2SO4=CuSO4+H2O;③Cu+H2O2+H2SO4=CuSO4+2H2O;
(2)2 耗能少或无污染等
(3)防止H2O2受热分解
(4)4900,3.06L 将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌
(5)减少硫酸铜晶体因溶于水而损失
Ⅱ、(1)白;
(2)2CuSO4
2CuO+2SO2↑+O2↑
(3)5,64%
(4)4CuO
2Cu2O+O2↑
Ⅲ、+2,CuSO4?3Cu(OH)2 蛋白质
| ||
CuO+H2SO4═CuSO4+H2O; Fe+CuSO4═FeSO4+Cu;
(2)从环保角度对两套方案的不同部分进行比较,甲方案第一步灼烧会产生污染空气的气体,粉尘,烟雾,由此可知方案2更合理;
(3)H2O2受热易分解,温度应该控制在50℃到60℃之间;
(4)设稀硫酸的质量为x,则36.8%x=1000mL×1.84g/mL×98%,得x=4900g;需要水的体积:(4900g-1000mL×1.84g/mL)÷1.0g/mL=3060mL,即3.06L.
稀释浓硫酸的方法是:将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌.
(5)硫酸铜晶体易溶于水,用少量95%的酒精淋洗后晾干,为的是减少硫酸铜晶体因溶于水而损失.
Ⅱ、(1)硫酸铜晶体(CuSO4?xH2O)是蓝色的,失去结晶水后变为白色;
(2)根据题意写出化学方程式:2CuSO4
| ||
(3)由图示数据和“到t1℃时该固体完全失去结晶水”可知,结晶水的质量为:12.50g-8.0g=4.5g
CuSO4?xH2O
| ||
160+18x 18x
12.50g 4.5g
∴
| 160+18x |
| 18x |
| 12.50g |
| 4.5g |
∴160+18x=50x,
∴x=
| 160 |
| 32 |
CuSO4?5H2O的CuSO4的质量分数
| 64+32+16×4 |
| 64+32+16×4+5×(1×2+16) |
)4.0g剩余固体继续加热到更高的温度,说明生成的氧化铜分解了,化学方程式为:4CuO
| ||
Ⅲ、Cu4(OH)6SO4中OH化合价为-1,SO4的化合价为-2,根据化合物中正负化合价的代数和为0,可得铜元素的化合价为+2;
Cu4(OH)6SO4可以写成盐和碱的形式为CuSO4?3Cu(OH)2;Cu2+是重金属使蛋白质失去活性,这说明病原菌的主体是蛋白质.
故答案为:
Ⅰ(1)①2Cu+O2
| ||
(2)2 耗能少或无污染等
(3)防止H2O2受热分解
(4)4900,3.06L 将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌
(5)减少硫酸铜晶体因溶于水而损失
Ⅱ、(1)白;
(2)2CuSO4
| ||
(3)5,64%
(4)4CuO
| ||
Ⅲ、+2,CuSO4?3Cu(OH)2 蛋白质
点评:该题为硫酸铜的知识为线索,考查了多方面的知识,难度较大.

练习册系列答案
相关题目