题目内容
【题目】硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,某兴趣小组对它开展了以下研究。
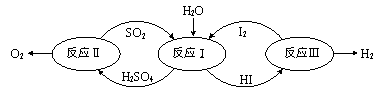
(1)、硝酸铜的制备研究
该小组同学查阅资料发现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
甲同学认为三种方案的反应都可以在铁制容器中进行,乙同学认为 (填“可行”“不
可行”),理由是(用一个化学方程式表示) 。从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法 ,理由是 , 。
(2)、硝酸铜的性质研究
硝酸铜为蓝色固体,溶于水可得蓝色溶液。该小组同学用下图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。

【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
① 氧化铜和稀硫酸反应的化学方程式:![]()
② 含氮化合物中,只有NO2是红棕色、有刺激性气味的气体。
③ NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成 ,还可能生成了CuO和O2。
【进行实验】

步骤II是同学们查阅了新的资料后设计完成的。该资料是关于NO2 方面的性质信息。
【获得结论】 根据实验结果,Cu(NO3)2受热分解的化学方程式为 。该小组同学取10 g的硝酸铜加热一段时间后,测得剩余固体的质量为4.6g,则硝酸铜的分解率为 ?(分解率为已分解的硝酸铜占原硝酸铜的质量分数,写出计算过程)
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性。理由是 。
【答案】(1)不可行 Fe+Cu(NO3)2===Cu+Fe(NO3)2 方案①②产生污染空气的有害气体 方案⑶的硝酸利用率高 (2)【猜想假设】:CuO 【进行实验】:向滤渣中加入中足量稀硫酸 带火星的木条复燃 NO2的沸点(或低温下NO2能否反应生成液态或固态物质)
【获得结论】:2Cu(NO3)2 === 2CuO+4NO2↑+O2↑ 92%
【反思与评价】:硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星的木条复燃而空气不能,说明NO2有助燃性。
【解析】
试题分析:①Cu与稀硝酸反应制取:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
甲同学认为三种方案的反应都可以在铁制容器中进行,乙同学认为不可行,理由是 Fe+Cu(NO3)2===Cu+Fe(NO3)2。从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法方案③,理由是方案①②产生污染空气的有害气体 方案⑶的硝酸利用率高;Cu(NO3)2受热分解除了生成氧化铜,还可能生成了CuO和O2。将反应后试管中的固体加水充分溶解,过滤,稀硫酸,加热,固体物质完全溶解,且溶液变为蓝色,步骤II是同学们查阅了新的资料后设计完成的。该资料是关于 NO2的沸点(或低温下NO2能否反应生成液态或固态物质)方面的性质信息。【获得结论】 根据实验结果,Cu(NO3)2受热分解的化学方程式为
![]() 。
。
解:设反应的硝酸铜的质量为x
![]() 固体减重
固体减重
376 160 216
X 10g-4.6g
列比例式得:376:X=216:(10克-4.6克)解得 X=9.2g
分解率为:9.2g/10g×100%=92%