题目内容
【题目】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | ﹣﹣ |
(1)表中数据a=g,b=g.
(2)请你在下边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线. 
(3)计算所用稀盐酸的溶质质量分数.
【答案】
(1)3.3;4.95
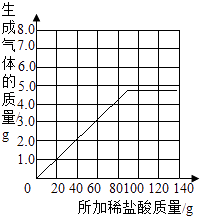
(2)解:根据描点连线得图如下:
(3)解:设20g盐酸中HCl的质量为x
Na2CO3+ | 2HCl═2NaCl+H2O+ | CO2↑ |
73 | 44 | |
x | 1.1g |
![]() =
= ![]()
x=1.825g
所用稀盐酸的溶质质量分数为 ![]() ×100%=9.125%
×100%=9.125%
答:所用稀盐酸的溶质质量分数9.125%
【解析】解:由表中数据可以看出,前两次每加入20g盐酸生成气体、都是1.1g,到第四次还是生成1.1gf,所以结论是每加入20g盐酸生成1.1g二氧化碳,所以第三次生成的气体为3.3g,而第五次只增加了0.55g气体,说明是碳酸钠已经完全反应,且可知是加入盐酸到90g时恰好完全反应.所以b为4.95g. 所以a=3.3g,b=4.95g
根据分析20g盐酸对应1.1g气体,40g盐酸对应2.2g气体,60g盐酸对应3.3g气体,80g盐酸对应4.4g气体,90g盐酸对应4.95g气体,之后气体不变,所以根据描点连线得图如下:
由于每20g盐酸对应1.1g气体
设20g盐酸中HCl的质量为x
Na2CO3+ | 2HCl═2NaCl+H2O+ | CO2↑ |
73 | 44 | |
x | 1.1g |
![]() =
= ![]()
x=1.825g
所用稀盐酸的溶质质量分数为 ![]() ×100%=9.125%(1)表中数据a=3.3g,b=4.95g.(2)请你在下边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线.
×100%=9.125%(1)表中数据a=3.3g,b=4.95g.(2)请你在下边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线. ;(3)所用稀盐酸的溶质质量分数9.125%.
;(3)所用稀盐酸的溶质质量分数9.125%.
【考点精析】掌握根据化学反应方程式的计算是解答本题的根本,需要知道各物质间质量比=系数×相对分子质量之比.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案