题目内容
【题目】某兴趣小组在室温下向一定体积10%的盐酸溶液中逐滴滴加10%的氢氧化钠溶液150mL(密度以1 g·mL-1计算),发现溶液温度先升高后降低,当氢氧化钠溶液的体积为100mL时,溶液的温度恰好达到最大值。
试回答下列问题:
(1)列式计算该实验得到的NaCI的质量_____(结果保留2位小数)。
(2)该小组将最后所得的溶液转移入蒸发皿中,边加热边用玻璃棒搅拌,当加热到_______时,停止加热,并用玻璃棒不断搅拌,利用余热将滤液蒸干,最后将所得固体多次烘干、称量,在确保本次实验固体不损失的情况下,得到的固体的质量小于150mL 10%的氢氧化钠溶液与盐酸完全反应后生成的固体质量,其原因是____________。
【答案】14.63g 等到蒸发皿中出现较多量的固体 过量50mL氢氧化钠溶液没有转化成氯化钠,而一定量的氢氧化钠转化为氯化钠时,固体的质量会增大
【解析】
(1)根据中和反应是放热反应;两者恰好完全反应时温度升到最高,根据溶质的质量分数的计算公式可求出参加反应的氢氧化钠的质量,然后利用化学方程式的计算可求出生成氯化钠质量;
(2)等到蒸发皿中出现较多量的固体时,停止加热,利用蒸发皿的余热使滤液蒸干.
(1)设,该实验得到的NaCI的质量为x,
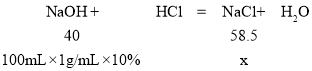
![]()
x=14.63g;
该实验得到的NaCI的质量为14.63g。
(2)蒸发时等到蒸发皿中出现较多量的固体时,停止加热,利用蒸发皿的余热使滤液蒸干;
得到的固体的质量小于150mL 10%的氢氧化钠溶液与盐酸完全反应后生成的固体质量,是因为过量50mL氢氧化钠溶液没有转化成氯化钠,而一定量的氢氧化钠转化为氯化钠时,固体的质量会增大。

【题目】兴趣小组围绕“实验室制取氧气”进行了一系列探究活动:
实验一 氧气制取实验
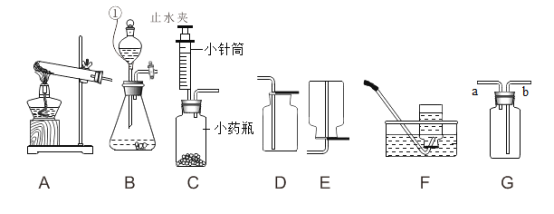
(1)现有如图装置
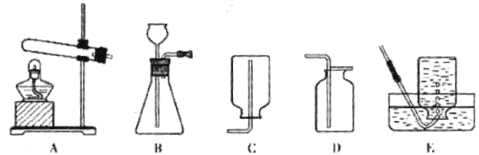
①药品选择:下列物质中不能作为制取氧气反应物的是_____(填标号),原因是_____
A 水
B 过氧化氢
C 氯化钾
D 高锰酸钾( KMnO4)
②实验室用高锰酸钾制取并收集较纯净氧气,应选择的发生装置和收集装置分别是_____(填标号, 下同)和_____。
③高锰酸钾制取氧气实验中出现了下列异常现象,请你分析其原因:
现象 | 原因 |
水槽中水呈紫红色 | Ⅰ:_____ |
水被倒吸沿导管进入试管中 | Ⅱ:_____ |
实验二 氯酸钾制取氧气
(2)取2g氯酸钾固体10份,分别加入不同质量的二氧化锰,加热反应,测得生成200mL氧气所用的时间,实验数据记录如下表:
实验編号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200mL氧气时间/秒 | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
请回答下列问题:
①实验室加热氯酸钾和二氧化锰制取氧气的文字表达式_____
②分析上述数据,利用此法制取氧气,二氧化锰与氯酸钾的最佳质量比为_____
③当二氧化锰与氯酸钾的质量比高于最佳比时,反应速率变低的原因是_____(填标号)。
A 反应物含量过低,温度不易达到反应温度
B 催化剂与氯酸钾接触面积减小
C 二氧化锰不起催化作用
实验三 探究过氧化氢 制取氧气的适宜催化剂
(3)实验方案如下:
I.用MnO2、CuO、Fe2O3、 Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球备用。
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用如图装置进行实验。改用其他三种微球,分别重复上述实验,得到如图的锥形瓶内压强随时间变化的曲线图。
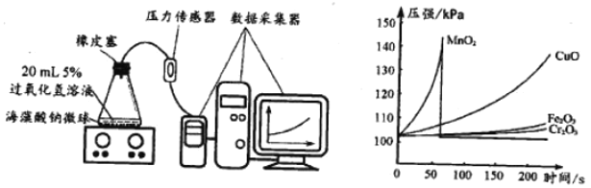
①每次实验时,海藻酸钠微球数应相同的原因_____
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是_____
③从实验曲线看,催化效果较好、反应温和的催化剂是_____