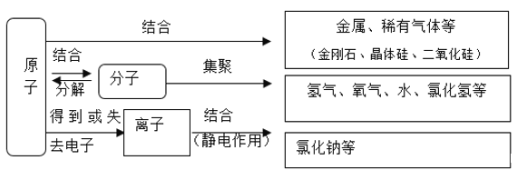
题目内容
【题目】一定条件下,在密闭容器内投入SO2、O2、SO3、V2O5四种物质,发生反应的化学方程式为2SO2+O2![]() 2SO3。在不同时刻测得容器内各物质的质量如下表所示,下列说法不正确的是
2SO3。在不同时刻测得容器内各物质的质量如下表所示,下列说法不正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
t1 | 80g | 5g | 100g | 5g |
t2 | a | 55g | 60g | b |
t3 | c | d | 40g | 5g |
A.甲是O2,丁是V2O5
B.a = 70g,d = 25g
C.参加反应的SO2、O2的分子个数比为2︰1
D.参加反应的SO2、O2的质量比为4︰1
【答案】B
【解析】
比较t1 、t3时刻丁的质量,可知丁在反应前后质量不变,所以丁是反应的催化剂,是V2O5;根据质量守恒定律,密闭容器内物质的总质量不变,故t1 、t2甲乙丙丁四种物质的总质量相等,80g+5g+100g+5g=a+55g+60g+b,b=5g,求得a=70g;由此判断,甲、乙、丙中只有乙的质量增加,甲、丙的质量减少,可知,乙是三氧化硫,反应的甲、乙、丙质量比为(80g-70g)::(55g-5g):(100g-60g)=10:50:40=1:5:4,可知甲是氧气,丙是二氧化硫。
A、根据分析,可知甲是氧气,丁是催化剂五氧化二矾,故A说法正确,不符合题意;
B、根据分析知,a = 70g,乙、丙质量比为5:4,结合t2 、t3时刻数据,(d-55g):(60g-40g)=5:4,d=80g,故B说法错误,符合题意;
C、根据方程式可知参加反应的SO2、O2的分子个数比为2︰1,故C说法正确,不符合题意;
D、根据分析并结合方程式可知,参加反应的SO2、O2的质量比为4︰1,故D说法正确,不符合题意。
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】图中A~I是初中化学常见的物质,且分别由一种或两种元素组成。A、H、I为液体,B、D、G为固体,其余物质为气体,且E有刺激性气味。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。
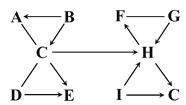
(1)写出化学式:H____________。
(2)写出化学方程式:
D → E ________________________。
B → A ________________________。
(3)点燃F前一定要检验其纯度,请完成检验F纯度的实验报告。
实验步骤 | 实验现象 | 实验结论 |
_______________ | ________________ | _______________ |
【题目】在一个密闭的容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量,数据见下表.下列说法错误的是( )
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 2 | 20 | 14 | 2 |
反应后质量/g | m | 28 | 0 | 8 |
A.m的值是2B.甲可能是该反应的催化剂
C.反应的乙、丁质量比是4:3D.该反应是化合反应