题目内容
【题目】某化工厂用废硫酸制备K2SO4的工艺流程如图所示,根据流程回答相关问题。
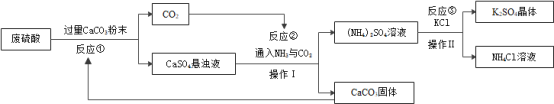
(1)反应①之前将CaCO3研成粉末的目的是______________,反应①的化学方程式为___________。
(2)实验室操作I时要用的一种玻璃仪器是___________。
(3)反应②的化学方程式为![]() ,则X的化学式为________________。
,则X的化学式为________________。
(4)反应③中相关物质的溶解度如下表所示:
物质 | (NH4)2SO4 | KCl | K2SO4 | NH4Cl |
溶解度/g(20° C) | 75.4 | 34.2 | 11.1 | 37.2 |
反应③在常温下能发生的原因是___________。
(5)上述流程中可循环使用的物质是_____________(填化学式)。
【答案】增大反应物之间的接触面积 ![]() 漏斗(或烧杯或玻璃棒) H2O 常温下参加反应的四种物质中K2SO4的溶解度最小 CO2和 CaCO3
漏斗(或烧杯或玻璃棒) H2O 常温下参加反应的四种物质中K2SO4的溶解度最小 CO2和 CaCO3
【解析】
(1)块状固体与液体之间的接触面积较小,反应①之前将CaCO3固体研成粉末的目的是增大反应物之间的接触面积,使反应更充分,反应①是碳酸钙与硫酸反应生成硫酸钙、二氧化碳和水,化学方程式为:![]() 。
。
(2)操作I得到一种固体和一种溶液,所以该操作为过滤,实验室进行过滤时要用的玻璃仪器有漏斗、烧杯和玻璃棒。
(3) 根据质量守恒定律,化学反应前后原子的种类和数目不变,反应前有钙、硫碳原子各1个,氢、氧原子各6个,氮原子2个;反应后有钙、硫碳原子各1个,氮原子2个,氧原子7个,氢原子8个,则X由1个氧原子,2个氢原子构成,则反应②中X的化学式为H2O。
(4)根据反应③中相关物质的溶解度,在常温下(NH4 )2SO4、KCl和NH4Cl均易溶于水,而K2SO4的溶解度相对较小,更容易析出晶体形成沉淀,符合复分解反应的发生条件,所以能在常温下能发生复分解反应,反应的化学方程式为![]() 。
。
(5)既是生成物又是反应物的物质可以循环使用,流程中可循环使用的物质是CO2和CaCO3。

【题目】小明在一次实验中,把硫酸铜溶液不小心滴到了浓度为5%的H2O2溶液中,发现立即有大量气泡产生。小明觉得很奇怪。
[提出问题]硫酸铜溶液中的哪种粒子能使双氧水分解的速率加快?
[作出猜想]猜想1: SO42-
猜想2:_________________。
猜想3: H2O
[讨论交流] 同学们经过讨论认为猜想_________错误,理由是____________。
[实验探究]
(1)甲组:
实验步骤 | 实验现象 | 实验结论 |
取10mL5%的H2O2溶液于试管中,加入___________。 | 无明显现象 | 猜想1错误 |
(2)乙组:
实验步骤 | 实验现象 | 实验结论 |
取10mL5%的H2O2溶液于试管中,加入__________。 | ________ | 猜想2正确 |
[反思与评价]小明经进一步实验确定硫酸铜是该反应催化剂,请写出该反应的化学方程式_________。
【题目】氢氧化钡可用作杀虫剂。实验室中有一瓶含有少量氢氧化钠的氢氧化钡样品,某化学兴趣小组的同学为测定该样品中氢氧化钡的质量分数,进行了以下实验:分别取120 g样品,平均分成6份加入烧杯中,分别加入80g水溶解,再加入碳酸钠溶液充分反应,对反应后的混合物进行如图所示的操作:
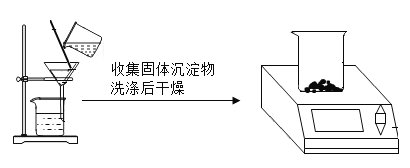
测得六组实验数据如下表所示,试计算:(钡的相对原子质量为137)
实验组数 | 第一组 | 第二组 | 第三组 | 第四组 | 第五组 | 第六组 |
加入碳酸钠溶液的质量/g | 25 | 50 | 75 | 100 | 125 | 150 |
天平示数/g | 3.94 | 7.88 | 11.82 | 15.76 | m | 19.70 |
(1)m的值为______________。
(2)样品中氢氧化钡的质量分数____________。
(3)将恰好反应的液体配制成溶质质量分数为10%的氢氧化钠溶液以便实验室使用,需要再称取____________克氢氧化钠固体?