题目内容
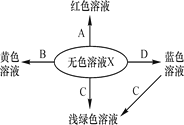
【题目】某工厂排出的废液中含有AgNO3、Zn(NO3)2、Cu(NO3)2三种物质。为了分离并回收金属银和铜,设计了如下实验方案:
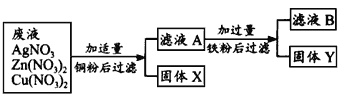
②
(1)步骤①中与铜粉反应的物质是________;
(2)步骤②中发生反应的化学方程式为________;
(3)从固体Y中得到金属铜的方法有:物理方法:________;化学方法:________。
【答案】硝酸银(AgNO3) Fe+Cu(NO3)2 = Fe(NO3)2 +Cu 利用磁铁吸引除去铁粉 将固体Y加入到足量的硫酸铜溶液中,然后过滤
【解析】
(1)在金属活动顺序中,铜的活动性大于银的活动性,小于锌的活动性,所以同分只能与硝酸银反应,故填硝酸银(AgNO3);
(2)步骤②中的反应是滤液A中的硝酸铜与铁反应生成咸酸亚铁和铜,故反应的化学方程式写为Fe+Cu(NO3)2 = Fe(NO3)2 +Cu;
(3)由题意分析可知,固体Y是剩余铁粉和生成铜的混和物,如果得到金属铜,可采取的物理方法是利用磁铁吸引除去铁粉,故填利用磁铁吸引除去铁粉;
化学方法:将固体Y加入到足量的硫酸铜溶液中,铁和硫酸铜反应生成可溶性的硫酸亚铁和铜,然后过滤就得到铜,故填将固体Y加入到足量的硫酸铜溶液中,然后过滤。

练习册系列答案
相关题目