题目内容
【题目】某小组用碳酸钠和石灰乳来制备烧碱,反应结束后滤去沉淀,将滤液蒸干得到粗产品.小组同学按实验流程对粗产品的纯度进行分析.
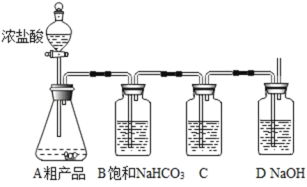
(1)实验资料:二氧化碳在饱和碳酸氢钠溶液中几乎不溶解.
(2)操作步骤:
①称量装置D的质量为m1克;
②连接好装置,检查气密性;
③将过量的浓盐酸慢慢滴加到盛有粗产品的锥形瓶中,直至无气泡冒出;
④再次称量装置D的质量为m2克(m1<m2;假设产生的气体均被装置D吸收).
(3)根据上述实验,回答下列问题:
①粗产品中一定有_____;一定没有_____.
②C中的试剂为_____(填物质的名称).
③该方案测得烧碱的纯度比理论值偏小,请分析“偏小”的原因_____;_____.写出一种具体的改进措施_____.
【答案】Na2CO3和NaOH Ca(OH)2 浓硫酸 装置A中挥发出氯化氢气体与装置B中的碳酸氢钠反应产生了二氧化碳气体 空气中的二氧化碳进入装置D中氢氧化钠溶液中 将浓盐酸改用稀盐酸
【解析】
①根据滴入浓盐酸有气泡产生,且m1<m2进行分析;
②根据水蒸气会对实验数据产生影响进行分析;
③根据浓盐酸具有挥发性,氢氧化钠右端的玻璃管与空气相同进行分析。
(3)①该实验是验证氢氧化钠的纯度,滴入浓盐酸,会产生气泡,氢氧化钠的质量增大,说明吸收了二氧化碳,粗产品中一定有:Na2CO3和NaOH;碳酸钠会与氢氧化钙发生反应,存在碳酸钠就不存在氢氧化钙;
②C装置需要将水蒸气除去,否则会对实验数据产生影响,可用浓硫酸;
③测得烧碱的纯度比理论值偏小,说明碳酸钠的质量增大了,浓盐酸具有挥发性,会与水反应生成盐酸,然后再与碳酸氢钠反应生成二氧化碳,氢氧化钠右端的玻璃管与空气相通,空气中的二氧化碳也会与氢氧化钠反应,所以:装置A中挥发出氯化氢气体与装置B中的碳酸氢钠反应产生了二氧化碳气体;空气中的二氧化碳进入装置D中氢氧化钠溶液中,减少氯化氢的挥发就可以了。