题目内容
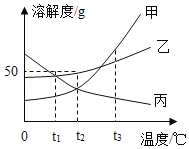
【题目】配制50g质量分数5%的KNO3溶液,作为无土栽培所需的营养液,溶解过程中KNO3的质量分数随时间变化关系如图所示,观察图象,分析形成这种结果的原因是( )
A. 所用KNO3固体中含有水分
B. 量简量水时俯视刻度线
C. KNO3固体溶解前所用烧杯内有水
D. 配好的溶液装瓶时部分液体洒落在试剂瓶外
【答案】B
【解析】
A、所用KNO3固体中含有水分,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故选项错误。
B、量简量水时俯视刻度线,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项正确。
C、KNO3固体溶解前所用烧杯内有水,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项错误。
D、配好的溶液装瓶时部分液体洒落在试剂瓶外,溶液具有均一性,溶质质量分数不变,故选项错误。
故选:B。

 阅读快车系列答案
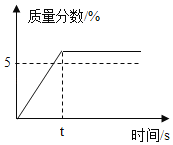
阅读快车系列答案【题目】小明同学将13.9g含杂质的的纯碱样品(碳酸钠与氯化钠的混合物)与90.5g稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示:
反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
气体质量m/g | 0 | 0.88 | 1.76 | 2.64 | 3.52 | 4.4 | 4.4 |
根据题目要求,回答下列问题:
(1)碳酸钠完全反应后,生成CO2的质量为_______________。
(2)求完全反应后所得溶液中溶质的质量分数__________。
【题目】冬季雾霾频发,某校社会实践小组的同学们,对某地区雾霾的成分、成因、危害及防治产生了浓厚的兴趣并开启了项目性学习之旅。
(信息检索)雾是浮游在空中的大量微小水滴。霾是可吸入颗粒物浓度较高造成的能见度较低的现象。霾的主要成分可能含有可溶性硫酸盐、硝酸盐,铵盐、不溶性有机物、黑碳、金属元素和其它元素。
(提出问题)某地霾的成分是什么?
(实验准备)选择该地重度雾霾天气,用SDLKC﹣1000型大流量TSP采样器在室外采集大气中的可吸入颗粒物10g。
活动一:探究霾中是否含有铵盐和硫酸盐。
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取5g样品,加少量熟石灰末,混合、研磨 | _______ | 含有铵盐 |
方案二 | 取5g样品,加适量水,充分溶解后过滤,向滤液中滴加_____ | 有白色沉淀生成 | 含有硫酸盐 |
(总结反思)工业上应加强对污染企业的监管,农业上应合理施用化肥。
活动二:探究霾中是否含有黑碳。同学们设计了如图所示的创新实验。(将活动一得到的残渣,干燥后置于中间凹槽内)
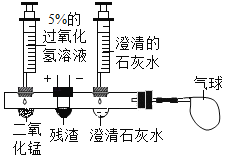
(实验步骤)①滴入过氧化氢溶液制取O2,排出装置内空气后,再在导管口接上气球。
②向右边的凹槽内滴入澄清的石灰水,
③接通电源,用热电阻丝点燃残渣
(实验现象)残渣剧烈燃烧,澄清石灰水浑浊,气球变大。
(实验结论)霾中含有黑碳。装置内澄清石灰水变浑浊的化学方程式是_____。
(交流研讨)某同学对“霾中含有黑碳”的结论产生质疑,理由是_____。
活动三:查阅资料,霾中还含有Al、Na、Zn、Pb、Hg、Cd等金属元素,其中的有害元素除Cd外,还有_____。
(能力发展)请你联系实际填写关于雾霾的问卷调查表:
项目 | 雾霾频发的成因 | 控制雾霾频发的做法 | 政府采取的应急措施 |
① | 能源结构不同 | 推广太阳能发电 | 人工降雨 |
② | 烧散煤取暖 | ______ | 向空中或地面洒水 |
③ | ______ | 推广新能源汽车 | 私家车限号出行 |
(检出进度)小组同学没有进行的探究项目是_____。
【题目】我市沿海地区大量养殖贝类海产品,贝壳中含有的碳酸钙是重要的工业原料。为了测定某种贝壳中碳酸钙的含量,取贝壳样品25.0g放入烧杯中,分五次加入稀盐酸,每次充分反应后称量(杂质不与稀盐酸反应),所加入稀盐酸的质量与烧杯中物质的质量的关系如下表:
加入稀盐酸的总质量(g) | 25.0 | 50.0 | 75.0 | 100.0 | 125.0 |
烧杯中物质的总质量(g) | 47.8 | 70.6 | 93.4 | 116.2 | 141.2 |
计算:
(1)当加入盐酸的总质量为50.0g时,充分反应后生成的气体质量是_____g。
(2)该贝壳样品中碳酸钙的质量分数。___________
【题目】化学是一门实用的基础科学,在人类社会的发展历程中起着重要作用。
正确认识物质
人们在实验研究中总结出常见金属的活动性顺序:
![]()
(1)表中□内对应的元素符号为______。
(2)Mg、Sn、Pt、Au四种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有_____种。
(3)Cu能从AgNO3溶液中置换出Ag,请说明理由:_____。
合理利用资源
(1)工业上用含氧化铁480t的赤铁矿为原料炼铁,得到含杂质4%的生铁_____t。
(2)化学小组通过实验将生锈铁钉回收处理。
(铁钉处理)
实验过程 | 实验现象 | 实验原理 | 保存方法 |
a.向盛有生锈铁钉的烧杯中加入稀盐酸,浸没铁钉 | 溶液由无色变为黄色、铁钉表面有气泡产生、铁锈脱落 | 请写出稀盐酸除铁锈的化学方程式:____ | 写出一条防止铁制品生锈的方法:____ |
b.取出铁钉,洗涤、干燥,妥善保管 | 铁钉呈现银白色 |
(3)小组同学提出,烧杯中的废液也可以回收处理。
(废液处理)
同学们查阅相关资料,获知:
a Fe2O3是一种红棕色粉末,俗称铁红,常用作红色油漆和涂料。
b FeCl2+2NaOH=Fe(OH)2↓+2NaCl
c 4Fe(OH)2+O2+2H2O=4Fe(OH)3
d 不溶性碱受热易分解,生成对应的金属氧化物和水。
实验流程:

①悬浊液A静置一天的原因是_____。
②操作I是_____。
③写出固体C转化为铁红的化学方程式_____。
促进科技发展
化学学科在合成药物等方面发挥若巨大作用,以下是几种常见的合成药物,请根据信息回答下列问题:
(1)解热镇痛药
阿司匹林是人们熟知的治感冒药,具有解热镇痛作用,化学式为C9H8O4,相对分子质量是_____。
(2)抗生素
青霉素是最重要的抗生素,即消炎药,能治疗肺炎和外伤感染等。青霉素中用得较多的是青霉素钠,化学式为C16H17O4N2SNa,其中氢、氧元素质量比为_____。
(3)抗酸药
抗酸药是一类治疗胃痛的药物,能中和胃里过多的盐酸,缓解胃部不适。抗酸药的种类很多,通常含有一种或几种化学物质,如NaHCO3、MgCO3、Mg(OH)2等。请写出其中一个与盐酸反应的化学方程式_____。