题目内容
【题目】我市沿海地区大量养殖贝类海产品,贝壳中含有的碳酸钙是重要的工业原料。为了测定某种贝壳中碳酸钙的含量,取贝壳样品25.0g放入烧杯中,分五次加入稀盐酸,每次充分反应后称量(杂质不与稀盐酸反应),所加入稀盐酸的质量与烧杯中物质的质量的关系如下表:
加入稀盐酸的总质量(g) | 25.0 | 50.0 | 75.0 | 100.0 | 125.0 |
烧杯中物质的总质量(g) | 47.8 | 70.6 | 93.4 | 116.2 | 141.2 |
计算:
(1)当加入盐酸的总质量为50.0g时,充分反应后生成的气体质量是_____g。
(2)该贝壳样品中碳酸钙的质量分数。___________
【答案】4.4 80%
【解析】
(1)当加入盐酸的总质量为50.0g时,充分反应后生成的气体质量是:25.0g+50.0g﹣70.6g=4.4g;
(2)经分析,当加入100.0g稀盐酸时,25.0g贝壳样品中的CaCO3恰好完全反应,此时生成CO2的质量为:100.0g+25.0g﹣116.2g=8.8g。
设25.0g贝壳样品中的CaCO3的质量为x。
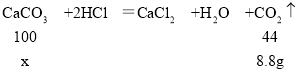
![]()
x=20.0g
该贝壳样品中CaCO3的质量分数为:![]() ×100%=80%
×100%=80%
答:该贝壳样品中CaCO3的质量分数为80%。

【题目】氢氧化钾是一种常见的碱.某化学兴趣小组的同学依据绿色化学的核心及原则,利用所学的化学知识,设计了制备氢氧化钾的方案,同时还可制得纯碱等物质,具体流程如图所示(部分反应、条件和产物已经略去):
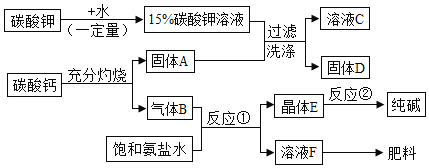
(提出问题1)溶液C中的溶质除氢氧化钾外,还含有什么?
(猜想与假设1)猜想1:K2CO3 猜想2:Ca(OH)2
(实验与探究1)小林同学设计了如下实验对猜想进行探究
实验操作 | 实验现象 | 实验结论 |
取少量溶液C于试管中,滴加稀盐酸 | _____ | 猜想1错误 |
同学们经过讨论分析后认为小林的实验结论不严密,理由是_____.
(提出问题2)固体D中的成分是什么?
(猜想与假设2)小军同学经分析认为一定含有CaCO3,原因是_____(用化学方程式表示);可能还含有_____.
(实验与探究2)请你设计一个简单可行的实验方案,证明固体D中存在猜想与假设2中可能还含有的物质_____(所用试剂只能为溶液).
(表达与交流)由反应①和反应②原理制备纯碱的方法就是我国著名的“侯氏制碱法”,请写出反应①的化学方程式_____.
(反思与评价)请你写出以上物质制备流程方案中体现绿色化学的核心及原则的一点_____.
【题目】完成实验报告的填写:
实验名称:铵态氮肥的检验。
实验目的:学习检验铵态氮肥的方法。
实验仪器和药品:研钵、试管、酒精灯、试管夹、胶头滴管、火柴、镊子、药匙、
氯化铵、碳酸氢铵、熟石灰、烧碱溶液、红色石蕊试纸、蒸馏水。
实验记录:
实验步骤 | 实验现象 | 实验结论、解释 |
(1)将氯化铵和熟石灰粉末在研钵中混合后,研磨,再闻气味。 | 闻到 ①_____。 | 铵态氮肥与碱反应生成氨气。 |
(2)用碳酸氢铵进行类似(1)的实验。 | ||
(3)将烧碱溶液滴入装有氯化铵的试管中,稍稍加热,用湿润的 ②_____接近试管口检验。 | 观察到 ③_____。 | 氯化铵与烧碱反应的化学方程式为 ④_____,氨水呈碱性。 |
(4)用碳酸氢铵进行类似(3)的实验。 |
【题目】(1)水与人类的生活密切相关。
①硬水给生活和生产带来许多麻烦,一般可用_____来区分硬水和软水。
②可利用活性炭吸附水中的异味和色素,活性炭的吸附性属于_____(填“物理”或“化学”)性质。
(2)下表是KNO3和Ca(OH)2在不同温度时的溶解度。回答有关问题:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
Ca(OH)2 | 0.19 | 0.17 | 0.16 | 0.14 | 0.13 | 0.11 | |
①两种物质中,溶解度随温度升高而减小的是_____。
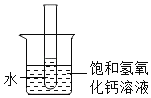
②60℃时,按图示操作:
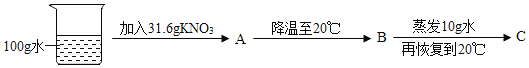
A中的溶液是_____(填“饱和”或“不饱和”)溶液。
C中析出固体的质量是_____g。
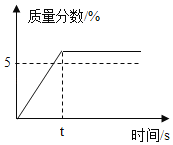
③如图,向烧杯中加入一定量的硝酸铵固体,此时试管中氢氧化钙溶液的溶质质量分数将_____(填“变大”不变”或“变小”)。