题目内容
【题目】内燃机的一个工作循环分为四个冲程。分别是吸气冲程、压缩冲程、做功冲程和排气冲程,燃料为汽油、柴油、天然气等。某内燃机吸气冲程和做功冲程气缸中微观粒子变化示意图如下:
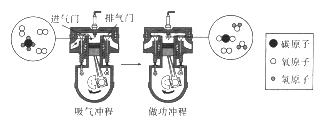
回答下列问题
(1)写出图中一种化合物的名称_______。
(2)该变化中的最小粒子是_______。
(3)上述化学反应中,反应物的分子个数比为_______。
【答案】 水(或甲烷或二氧化碳) 碳原子、氢原子、氧原子 1:2(或2:1)
【解析】本题考查了微观示意图的应用。
(1)水是由氢、氧两种元素组成的化合物,甲烷是由碳、氧两种元素组成的化合物,二氧化碳是由碳、氧两种元素组成的化合物,图中化合物有水(或甲烷或二氧化碳);
(2)化学变化中的最小粒子是原子,该变化中的最小粒子是碳原子、氢原子、氧原子;
(3)根据图示可知该反应是甲烷与氧气反应生成二氧化碳和水,反应的化学方程式是:CH4 + 2O2 点燃 CO2 + 2H2O,化学反应中反应物的分子个数比为1:2(或2:1)。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】阅读下面科普短文。
漫谈水果的保鲜
“日啖荔枝三百颗,不辞长做岭南人”,表达了诗人赞美荔枝甘美、喜爱荔枝之情。水果不仅带给我们味觉上的美好享受,更能提供丰富的营养。但是有时水果的保存也会给我们带来小小的烦恼,保存不当,水果会失水或腐烂变质。
在水果的冰点温度下储藏,能较长时间保持鲜果固有的品质和营养,这项技术叫冰温储藏。为了探究荔枝的冰温储藏(荔枝的冰点温度为-1.2℃)是否优于普通冷藏(温度通常为0~10℃)。科研人员设计了一组实验,实验条件如表1所示。以荔枝的还原糖含量作为衡量荔枝品质变化的指标(还原糖含量越高,品质越好),每隔七天进行一次水果品质检测,实验结果见图1。
表1 实验条件
组号 | 储藏温度 | 湿度 | 备注 |
1 | -1.2℃ | 87% | 荔枝的品种、大小、成熟度、数量以及其他条件均相同且适宜 |
2 | 3℃ | 87% |

图1 还原糖含量变化
氧气的浓度也影响着水果的保鲜。在储存水果时为了抑制呼吸作用,一般要降低氧气的浓度,当二氧化碳释放量最小时,呼吸作用最弱,此时对应的氧气浓度适宜水果的储存。如果降得太低,植物组织就进行无氧呼吸,无氧呼吸的产物往往对细胞有一定的毒害作用,影响蔬菜水果的保鲜。
此外,储存时还要注意有些水果不能和其他蔬果一起存放,如苹果、木瓜、香蕉等。这类水果在成熟过程中会释放“乙烯”气体,可加速水果的成熟和老化。坏掉的水果也会释放乙烯,因此在一堆水果中,如果有一颗是坏的,要尽快挑出去。
依据文章内容,回答下列问题:
(1)乙烯___________(填“能”或“不能”)催熟水果。
(2)在文中的荔枝实验中,研究的影响水果储藏的因素是 ________。
(3)通过图1可得到的信息是________(写出1条即可)。
(4)下列说法不正确的是________。
A.荔枝的还原糖含量在冰温储藏时始终高于普通储藏
B.氧气浓度越低越有利于水果的保鲜
C.普通冷藏温度指的是3℃
(5)请举出日常生活中水果保鲜的方法_________(写出一种即可)。
【题目】铝是一种应用广泛的金属。某兴趣小组对金属铝展开了系列研究。
I 研究铝的化学性质
(1)铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为_________ 。 实验前,需要对铝的表面先进行______________(填操作)处理。兴趣小组同学将铝处理好后剪 成若干大小相同的小片,用于后续实验。
(2)铝和酸、碱、盐溶液的反应
实验 | 操作 | 现象 | 结论 |
一 | 将铝片放入稀 盐酸中 | ______________,试管变烫 | 铝能与盐酸发生反应,反应放热 |
二 | 将铝片放入氢 氧化钠溶液中 | 铝表面有气泡产生,试管变 烫 | 铝能与氢氧化钠溶液反应,反应 放热 |
三 | 将铝放入硫酸 铜溶液中 | 铝表面有红色物质产生,溶 液逐渐变成无色 | 金属活动性:铝_____铜 |
实验一的现象为______________________。实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为______________________。实验三表明,铝的金属活动性_____________(填“大于“或”小于“)铜。
(3)小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内 发现铝片表面产生的气泡较少,反应较慢。
对比上述两组实验产生猜想。 猜想①:稀盐酸中的氯离子对反应可能有促进作用。 猜想②:_____。
为验证猜想①是否合理,应在铝和稀硫酸中加入___________(填字母),观察现象。
A.Na2SO4 B.Na2CO3 C.NaCl
II 测定某铝样品中金属铝的质量分数
【资料1】氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
【资料2】AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl。
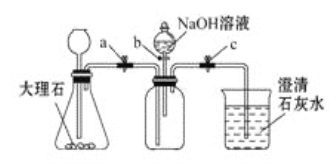
(4)小组同学称取4.62g某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加入足量稀盐酸至完全反应。将反应后的液体分成溶液1和溶液2两等份,设计两种实验方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。
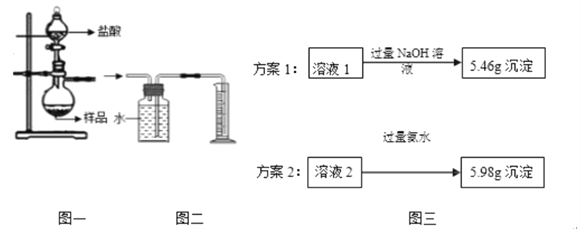
①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程).
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积, 计算后发现金属铝的质量分数偏大,可能的原因是?