题目内容
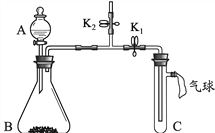
【题目】欲测定某碳酸钠样品中碳酸钠的质量分数,取13.25g含有氯化钠杂质的碳酸钠样品,加入50g14.6%的盐酸溶液,二者恰好完全反应,试求:
(1)样品中碳酸钠的质量分数;(2)反应后溶液中氯化钠的质量分数.(结果精确到0.1%)
【答案】80%,24.4%。
【解析】根据恰好完全反应时消耗稀盐酸的质量结合反应的化学方程式求出样品中碳酸钠的质量,从求出碳酸钠的质量分数及相关计算解答。
(1)设样品中碳酸钠的质量为x,反应生成氯化钠的质量为y,生成二氧化碳的质量为z。
Na2CO3 + 2HCl =2NaCl + H2O + CO2↑
106 73 117 44
x 50g×14.6% y z
![]()
x=10.6g
y=11.7g
z=4.4g
样品中碳酸钠的质量分数=![]() ×100%=80%
×100%=80%
(2)反应后溶液中氯化钠的质量分数=![]() ×100%=24.4%
×100%=24.4%
答:(1)样品中碳酸钠的质量分数为80%;(2)反应后溶液中氯化钠的质量分数为24.4%。

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
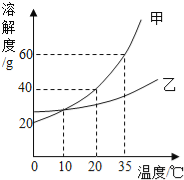
【题目】分析处理图表信息是学习的一种重要方法。下表是氯化钠和硝酸钾在不同温度下的溶解度。
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 31.6 | 63.9 | 110 | 169 | |
这两种固体物质在水中的溶解度曲线如图所示:
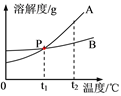
请仔细阅读图表后回答下列问题:
(1)A曲线表示的是________的溶解度曲线。(填“NaCl”或“KNO3”)
(2)P点的含义是___________________________。
(3)t2℃时,将等质量的A和B的饱和溶液降温至t1℃,所得溶液的质量大小关系是A____B。(填“<”、“>”或“=”)