题目内容
【题目】在20℃环境中,制取干燥的二氧化碳气体,并验证二氧化碳气体与氢氧化钠溶液可以发生化学反应,设计如下探究实验。
(查阅资料)(1)碳酸钠、水、二氧化碳可以化合生成碳酸氢钠。
(2)20℃,氢氧化钠、碳酸钠和碳酸氢钠的溶解度如下表所示
物质 | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 110 | 21.8 | 9.6 |
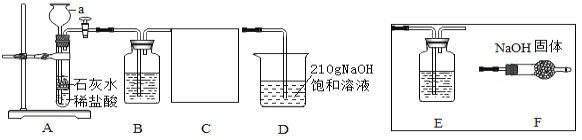
(定性探究)(1)仪器a的名称是____________________;
(2)装置B中盛有 NaHCO3溶液,目的是吸收装置A中挥发出的HCl气体,写出B中发生反应的化学方程式:_______________;
(3)装置C的作用是______________,选择________(选填E、F)达到实验目的;
(4)在实验过程中装置D中观察到______________,说明CO2和NaOH溶液能发生反应。
(定量计算)
(5)装置D中NaOH全部转化成Na2CO3时,理论上最多可以生成Na2CO3多少克____________?
(6)当向装置D中通入足量的CO2时,可以将NaOH全部转化为NaHCO3,实验过程中会析出的NaHCO3质量___________g(不考虑结晶水)。
【答案】长颈漏斗 NaHCO3+HCl=NaCl+H2O+CO2↑ 干燥 E 有晶体析出 145.75g 221.4
【解析】
(1)仪器a的是长颈漏斗;
(2)HCl气体溶于水是盐酸,能与NaHCO3溶液反应生成氯化钠、水、二氧化碳,NaHCO3+HCl=NaCl+H2O+CO2↑
(3)装置B中盛有 NaHCO3溶液,目的是吸收装置A中挥发出的HCl气体,装置C的作用是吸收二氧化碳气体中混有的水蒸气,由于二氧化碳能与氢氧化钠反应,不能选择F,应该选择E,由于浓硫酸具有吸水性,可干燥二氧化碳,E中盛放浓硫酸。
(4)20℃时,NaOH的溶解度是110g,则210gNaOH饱和溶液中含有100g的水,110g的氢氧化钠,2NaOH +CO2=Na2CO3 +H2O,设110gNaOH与二氧化碳反应后生成Na2CO3 的质量为x。

![]() ,解得x=145.75g,
,解得x=145.75g,
20℃时,Na2CO3的溶解度是21.8g,所以在实验过程中装置D中可观察到有晶体析出,说明CO2和NaOH溶液能发生反应。
(5)20℃时,NaOH的溶解度是110g,则210gNaOH饱和溶液中含有100g的水,110g的氢氧化钠,2NaOH +CO2=Na2CO3 +H2O,设110gNaOH与二氧化碳反应后生成Na2CO3 的质量为x。

![]() ,解得x=145.75g
,解得x=145.75g
(6)2NaOH +CO2=Na2CO3 +H2O,Na2CO3+H2O+CO2=2NaHCO3,所以 NaOH———NaHCO3,变化过程中水的质量不变,设110gNaOH发生反应转化为NaHCO3的质量为y。

![]() ,解得y=231g,20℃时,NaHCO3的溶解度是9.6g,所以析出晶体的质量是:231g-9.6=221.4g
,解得y=231g,20℃时,NaHCO3的溶解度是9.6g,所以析出晶体的质量是:231g-9.6=221.4g

【题目】某公司生产的新型融雪剂的成分是无水CaCl2和少量的氯化钠,为测定融雪剂中氯化钙的含量,化学兴趣小组的同学称取该样品12g,加水充分溶解,得到溶液50g,然后取一定质量分数的碳酸钠溶液100g平均分五次加入,充分振荡,实验数据见表。请你分析数据并进行有关计算。
次 数 | 1 | 2 | 3 | 4 | 5 |
加入碳酸钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/g | 2.5 | x | 7.5 | 10 | 10 |
(1)上表中x的数值为_____。第_____次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是多少_____?
(3)恰好完全反应时过滤,所得不饱和溶液的溶质质量分数是多少_____?