题目内容
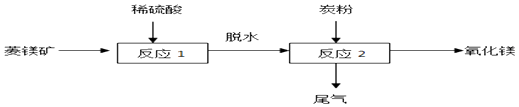
【题目】碱式碳酸镁是白色粉末,不溶于水,可用于镁盐制备、制药工业等,其组成一般以 xMgCO3yMg(OH)2zH2O 表示.某化学兴趣小组同学在老师带领下参观了碱式碳酸镁的生产流 程,并设计实验确定碱式碳酸镁的组成. Ⅰ碱式碳酸镁的制备(图1)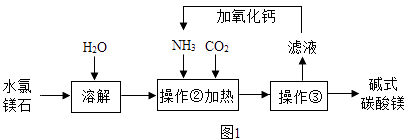
(1)操作③的名称是 .
(2)上述流程中 NH3 被循环使用,流程中生成 NH3的化学方程式为:①CaO+H2O═Ca(OH)2; ② .
(3)判断碱式碳酸镁是否洗涤干净,可向最后的洗出液中滴加 (填字母),观察现象判断.
A.盐酸和氯化钡的混合液
B.硝酸和硝酸银的混合液
C.碳酸钠溶液
D.稀盐酸
(4)实验室可用复盐 MgCO3(NH4)2CO3H2O 作原料制备碱式碳酸 镁.取一定量原料放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅 中加热(如图2所示),加入一定量蒸馏水,开启搅拌器同时加入预定 的氨水,待温度达 40℃时滴加卤水并继续滴入氨水,一段时间后通 过系列实验操作得到碱式碳酸镁产品.实验中搅拌的目的是 , 水浴加热的优点是 . 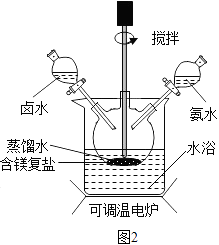
(5)Ⅱ测定碱式碳酸镁的组成 【查阅资料】
①MgCO3 ![]() MgO+CO2↑.②Mg(OH)2
MgO+CO2↑.②Mg(OH)2 ![]() MgO+H2O.
MgO+H2O.
【实验设计】(图3)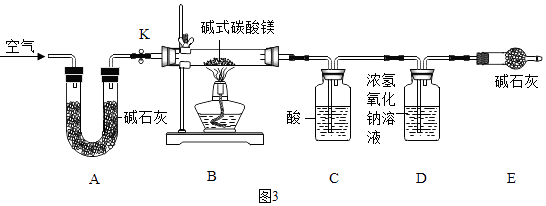
C 中的物质是(填名称).实验过程中,当关闭 K 后,加热 B 装置,判断碱式碳 酸镁完全分解的方法是:当观察到 C 中 , 则其已完全分解.D 处常用浓氢氧化钠溶液 而不用饱和石灰水的原因是 .
(6)【数据分析】 取碱式碳酸镁[xMgCO3yMg(OH)2zH2O]4.66g,高温煅烧至恒重,得到固体 2.00g,CO21.76g,试通过计算确定该碱式碳酸镁中 x:y 的最简整数比(请写出计算过程).
(7)若没有 A 装置,则测定得到的 z 值(填“偏大”、“偏小”、“无影响”).
【答案】
(1)过滤
(2)2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
(3)B
(4)使反应物充分混合接触,提高反应速率;反应物受热均匀
(5)浓硫酸;无气泡产生;等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳
(6)解:设碱式碳酸镁中碳酸镁质量为x,生成氧化镁质量为y,
MgCO3 | MgO+ | CO2↑ |
84 | 40 | 44 |
x | y | 1.76g |
![]() =
= ![]() =
= ![]() ,
,
x=3.36g,y=1.6g,
设碱式碳酸镁中氢氧化镁质量为z,
碱式碳酸镁分解生成氧化镁质量为:2.00g﹣1.6g=0.4g,
Mg(OH)2 | MgO+H2O |
58 | 40 |
z | 0.4g |
![]() =
= ![]() ,
,
z=0.58g,
![]() :
: ![]() =x:y,
=x:y,
x:y=4:1,
答:该碱式碳酸镁中 x:y 的最简整数比是4:1.
(7)偏大
【解析】解:(1)操作③的名称是过滤,提供过滤把液体和固体分离. 故填:过滤.(2)上述流程中,加热条件下,氯化铵和氢氧化钙反应生成氯化钙、水和氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑.
CaCl2+2H2O+2NH3↑.
故填:2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑.(3)判断碱式碳酸镁是否洗涤干净,可向最后的洗出液中滴加硝酸和硝酸银的混合液,如果不产生白色沉淀,说明已经洗涤干净.
CaCl2+2H2O+2NH3↑.(3)判断碱式碳酸镁是否洗涤干净,可向最后的洗出液中滴加硝酸和硝酸银的混合液,如果不产生白色沉淀,说明已经洗涤干净.
故选:B.(4)实验中搅拌的目的是使反应物充分混合接触,提高反应速率;
水浴加热的优点是反应物受热均匀.
故填:使反应物充分混合接触,提高反应速率;反应物受热均匀.(5)C 中的物质是浓硫酸,用来吸收水蒸气;
实验过程中,当关闭 K 后,加热B装置,判断碱式碳酸镁完全分解的方法是:当观察到C中无气泡产生,则其已完全分解;
D处常用浓氢氧化钠溶液 而不用饱和石灰水的原因是等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳.
故填:浓硫酸;无气泡产生;等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳.(7)若没有 A 装置,空气中的水蒸气会进入C装置中,则会导致反应生成的水偏大,从而导致测定得到的z值偏大.
故填:偏大.
(1)操作③的名称是过滤,通过过滤能够把固体和液体分离;(2)加热条件下,氯化铵和氢氧化钙反应生成氯化钙、水和氨气;(3)氯离子能和银离子结合成不溶于稀硝酸的白色沉淀氯化银;(4)反应物接触越充分,分解速率越快;(5)浓硫酸具有吸水性,可以用作某些气体的干燥剂;相同条件下,氢氧化钠的溶解度远大于氢氧化钙的溶解度;(6)根据提供的数据及其反应的化学方程式可以计算判断相关方面的问题;(7)若没有 A 装置,空气中的水蒸气会进入C装置中.