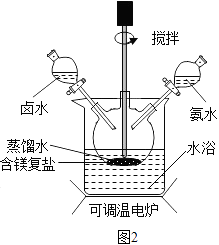
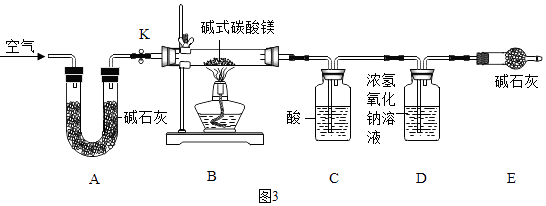
题目内容
【题目】我国高纯氧化镁产品供不应求,工业上可以用硫酸镁还原热解制备,工业流程如下: 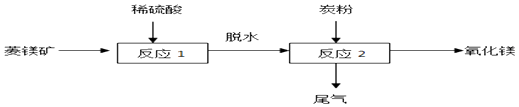
(1)菱镁矿主要成分是碳酸镁,反应前要粉粹,目的是 , 反应1化学反应方程式为 .
(2)反应2中的化学方程式为:2MgSO4+C ![]() 2MgO+2SO2↑+ .
2MgO+2SO2↑+ .
(3)反应2中硫酸镁与炭的配比对硫酸镁转化率的影响如下图1,硫酸镁转化率最高时m(MgSO4):m(C)= , 当配炭比2:1~3:1时硫酸镁转化率低的原因是 . 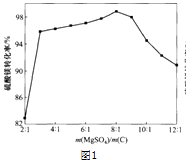
(4)反应2中时间和温度对硫酸镁转化率的影响分别如下图2、图3,则最佳的时间和温度分别为h、℃. 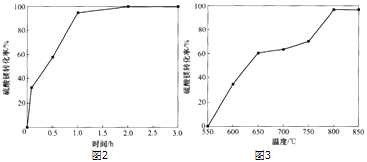
(5)尾气直接排放到空气中会引起、两个当今世界全球性问题,可以用石灰浆吸收其中的有毒气体,化学方程式为: .
【答案】
(1)增大反应物接触面积,加快反应速率;MgCO3+H2SO4═MgSO4+H2O+CO2↑
(2)CO2↑
(3)8:1;炭粉较多,硫酸镁被炭粉包裹,受热面积小,传热性降低
(4)2;800
(5)温室效应;酸雨;Ca(OH)2+SO2═CaSO3↓+H2O
【解析】解:(1)菱镁矿主要成分是碳酸镁,反应前要粉粹,目的是增大反应物接触面积,加快反应速率; 碳酸镁和稀硫酸反应生成硫酸镁、水和二氧化碳,反应的化学方程式为:MgCO3+H2SO4═MgSO4+H2O+CO2↑.
故填:增大反应物接触面积,加快反应速率;MgCO3+H2SO4═MgSO4+H2O+CO2↑.(2)由反应的化学方程式可知,反应前后镁原子和硫原子都是2个,反应前碳原子是1个,反应后应该是1个,反应前氧原子是8个,反应后应该是8个,因此未知物质是二氧化碳,反应的化学方程式为:2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑.
2MgO+2SO2↑+CO2↑.
故填:CO2↑.(3)由图1,硫酸镁转化率最高时m(MgSO4):m(C)=8:1,当配炭比2:1~3:1时硫酸镁转化率低的原因是炭粉较多,硫酸镁被炭粉包裹,受热面积小,传热性降低.
故填:8:1;炭粉较多,硫酸镁被炭粉包裹,受热面积小,传热性降低.(4)由图2、图3可知,最佳的时间和温度分别为2h、800℃.
故填:2;800.(5)尾气直接排放到空气中会引起温室效应、酸雨两个当今世界全球性问题;
可以用石灰浆吸收其中的有毒气体二氧化硫,石灰浆中的氢氧化钙和二氧化硫反应生成亚硫酸钙和水,反应的化学方程式为:Ca(OH)2+SO2═CaSO3↓+H2O.
故填:温室效应;酸雨;Ca(OH)2+SO2═CaSO3↓+H2O.
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.

【题目】开放日,化学兴趣小组的同学自拟研究主题,对过氧化氢分解反应及催化剂做研究:
(1)小红的实验方案为:
| 3g氧化铜 | 3g氧化铁 | 3g二氧化锰 | 3g氧化铝 |
10%过氧化氢溶液10mL | 2.8 | 3.4 | 1.5 | 5.7 |
她要探究的问题是 , 通过实验,她得出结论是 .
(2)小明的实验报告如图所示
| 30% H2O2 10mL | 15% H2O2 10mL | 5% H2O2 10mL |
加入agMnO2 | 0.2 | 0.8 | 2.0 |
小明通过分析数据,得出的结论是 .
(3)小刚的探究过程如下:
①【问题】MgO能不能作过氧化氢分解的催化剂呢?
②【猜想】MgO能作过氧化氢分解的催化剂.
③【实验验证】
实验步骤 | 实验现象 | 实验结论 | |
实验一 | A | 木条不复燃 | 常温下过氧化氢溶液不分解 |
实验二 | 在装有10mL15% 过氧化氢溶液的试管中加入少量MgO,然后将带火星的木条伸入试管中 | 木条复燃 | B |
④【结论】MgO能加快过氧化氢的分解速率,故MgO能作过氧化氢分解的催化剂.实验结束后,小组同学进行了交流讨论,认为小刚的猜想还不能得到证实,理由是 .
参与了课外小组的研究后,是否触发了你的灵感?关于过氧化氢分解以及催化剂问题,你想研究的问题是 .
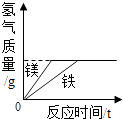
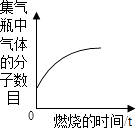
【题目】下列四个图象能正确反映实验变化关系的有( )
A | B | C | D |
|
|
|
|
常温下,足量的镁、铁分别同时放入少量等质量、等质量分数的稀盐酸中 | 敞口放置于空气中的浓硫酸或稀盐酸 | 加热KNO3、Ca(OH)2的饱和溶液(不考虑溶剂的蒸发) | 少量的碳在密闭的集气瓶中与氧气完全燃烧 |
A.A
B.B
C.C
D.D