题目内容
用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质):某化学兴趣小组为了测量纯碱样品中碳酸钠的质量分数,做了如下实验:称量某纯碱样品12 g,加入到足量的氯化钡溶液中,恰好完全反应。过滤干燥后,称得沉淀质量为19.7g。
请计算:纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%)。
请计算:纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%)。
88.3%
碳酸钠与氯化钡溶液反应的化学方程式为:Na2CO3+BaCl2=
BaCO3↓+2NaCl,利用化学方程式,根据沉淀BaCO3的质量19.7 g,可求出样品中碳酸钠的质量,从而进一步求出样品中碳酸钠的质量分数。
解:设样品中碳酸钠的质量为x
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197
x 19.7 g
 =
=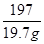
x=10.6 g
所以样品中碳酸钠的质量分数为
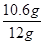 ×100%≈88.3%
×100%≈88.3%
答:纯碱样品中碳酸钠的质量分数约为88.3%。
BaCO3↓+2NaCl,利用化学方程式,根据沉淀BaCO3的质量19.7 g,可求出样品中碳酸钠的质量,从而进一步求出样品中碳酸钠的质量分数。
解:设样品中碳酸钠的质量为x
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197
x 19.7 g
 =
=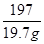
x=10.6 g
所以样品中碳酸钠的质量分数为
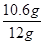 ×100%≈88.3%
×100%≈88.3%答:纯碱样品中碳酸钠的质量分数约为88.3%。

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
 2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)
2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)