题目内容
黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜样品中铜的质量分数,现取10 g该样品粉碎,加入到50 g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5 g。计算:
(1)黄铜样品中铜的质量分数。
(2)稀硫酸中溶质的质量分数。
(3)由此得到启示是:在使用黄铜制品时应注意 。(合理即可)
(1)黄铜样品中铜的质量分数。
(2)稀硫酸中溶质的质量分数。
(3)由此得到启示是:在使用黄铜制品时应注意 。(合理即可)
(1)黄铜样品中铜的质量分数为35%。
(2)稀硫酸中溶质的质量分数为19.6%。
(3)避免与酸接触(合理即可)
(2)稀硫酸中溶质的质量分数为19.6%。
(3)避免与酸接触(合理即可)
(1)黄铜样品中铜的质量分数为: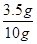 100%=35%
100%=35%
(2)10 g该样品中,锌的质量为:10 g-3.5 g=6.5 g
设稀硫酸中溶质的质量为x
Zn + H2SO4=ZnSO4+H2↑
65 98
6.5 g x
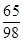 =
=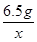
x=9.8 g
稀硫酸中溶质的质量分数为:
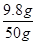 ×100%=19.6%
×100%=19.6%
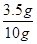 100%=35%
100%=35%(2)10 g该样品中,锌的质量为:10 g-3.5 g=6.5 g
设稀硫酸中溶质的质量为x
Zn + H2SO4=ZnSO4+H2↑
65 98
6.5 g x
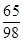 =
=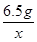
x=9.8 g
稀硫酸中溶质的质量分数为:
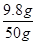 ×100%=19.6%
×100%=19.6%
练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目


 CaO+CO2↑)
CaO+CO2↑) 2H2↑+ O2 ↑)
2H2↑+ O2 ↑) 2 CO2+ 3 H2O 。
2 CO2+ 3 H2O 。