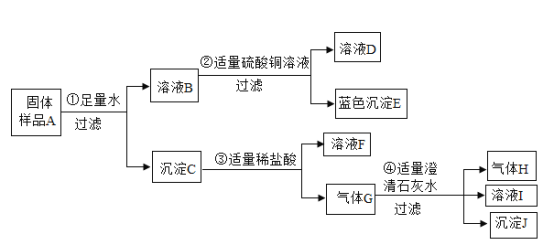
题目内容
【题目】金属在生产、生活中应用广泛。
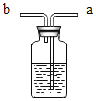
(1)钢铁制品是应用广泛的金属材料。据估计,每年全世界被腐蚀损耗的钢铁材料约占全年钢材产量的十分之一。某校化学兴趣小组的同学为探究金属腐蚀的原因,设计如下实验:
![]()
①如图,取一根约10cm的光亮铁钉放在自来水中,观察A、B、C三处的变化。几天后,他们会发现处_______最先出现铁锈,结合所学知识分析可知,铁在空气中生锈实际上是铁与______________相互作用发生一系列复杂的化学反应的过程。
②请你帮兴趣小组的同学写出一条保护金属资源的有效途径_________________________________。
(2)某同学为了验证Fe、Cu、Ag三种金属的活动性顺序,设计了如下方案,下列方案中能验证三种金属活动性顺序的是____________________________(填字母)。
A Ag、Cu、Fe( NO3)2溶液
B Ag、 Fe、Cu( NO3)2溶液
C Cu、 Fe( NO3 )2溶液、AgNO3溶液
D Fe 、Cu( NO3 )2溶液、AgNO3溶液
(3)向FeCl2和CuCl2的混合溶液中加入Zn、Mg和Fe的混合粉末,充分反应后过滤,洗涤,得到滤液和滤渣。下列说法正确的是_________________________(填字母)。
A 若滤渣中只含有Cu和Fe,滤液中一定含有氯化镁、氯化锌
B 向滤渣中加入足量稀盐酸,溶液变为浅绿色,则滤渣中一定含有Fe,一定不含Mg
C 若滤液呈浅绿色,则滤渣中一定含有Cu和Fe
【答案】B 氧气和水蒸气 防止金属腐蚀(或金属的回收利用等合理即可) BC A
【解析】
(1)①铁钉B处同时与空气中的氧气和水蒸气接触最先生锈,根据所学知识可知铁在空气中生锈实际上是铁与空气中的氧气和水蒸气共同作用的结果。故填:B;氧气和水蒸气;
②保护金属资源的有效途径有防止金属的腐蚀,金属的回收利用,有计划、合理地开采矿物,寻找金属的代用品。故填:防止金属腐蚀(或金属的回收利用等合理即可);
(2)A、将银、铜分别放入硝酸亚铁溶液中,银、铜均不反应,可知三种金属中铁最活泼,但无法比较银、铜的活动性强弱,A错误;
B、将银、铁分别放入硝酸铜溶液中,银不反应、铁反应,可知三种金属中铁最活泼、银最不活泼,B正确;
C、将铜分别放入硝酸亚铁、硝酸银溶液中,铜不与硝酸亚铁溶液反应,说明铁比铜活泼,铜与硝酸银溶液反应,说明银不如铜活泼,C正确;
D、将铁分别放入硝酸铜、硝酸银溶液中,均发生反应,说明三种金属中铁最活泼,但无法比较铜、银的活动性强弱,D错误。
故选:BC;
(3)向氯化亚铁和氯化铜的混合溶液中加入Zn、Mg和Fe的混合粉末,涉及到的金属的活动性顺序为Mg>Zn> Fe> Cu。金属Mg先与氯化铜发生反应,再与氯化亚铁发生反应。锌也是先与氯化铜发生反应,再与氯化亚铁发生反应,铁只与氯化铜发生反应。
A、若滤渣中只含有Cu和Fe,则氯化铜一定反应完全,滤渣中的铁可能是镁或锌与氯化亚铁反应生成的,也可能是未参与反应或反应后剩余的铁,则滤液中一定含有氯化镁、氯化锌,可能含有氯化亚铁,A正确;
B、向滤渣中加入足量稀盐酸,溶液变为浅绿色,说明滤渣中一定含有Fe,可能含有Zn或Mg,B错误;
C、若滤液呈浅绿色,说明滤液中不含氯化铜,氯化铜已完全反应,则滤渣中一定含有铜,铁可能与氯化铜恰好完全反应,则滤渣中可能含有铁,C错误。
故选:A。

【题目】为测定某黄铜(铜、锌合金)中铜的质量分数,称取32.5g该黄铜粉末放入烧杯中,再向烧杯内加入200g稀硫酸(足量),每隔10分钟测烧杯内(不含烧杯)剩余物质的质量,测得数据如表:
加入稀硫酸后10分钟 | 加入稀硫酸后20分钟 | 加入稀硫酸后 | 加入稀硫酸后40分钟 | 加入稀硫酸后50分钟 |
232.4g | 232.3g | 232.2g | 232.1g | 232.1g |
(1)完全反应后生成氢气的质量为______g.
(2)计算该黄铜中铜的质量分数为________(写出计算过程).