题目内容
【题目】某校化学兴趣小组进行了有关影响金属和酸反应的影响因素的实验探究。
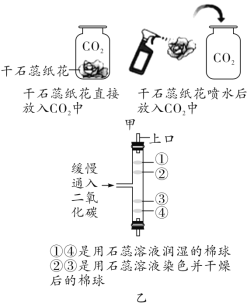
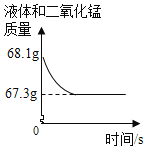
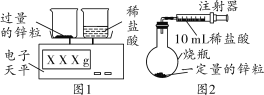
小亮设计了如下实验(如图1):发现随着反应的进行,产生气体的速度逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应过程中,溶液的温度也先随之升高,最后下降到室温。
(提出问题)一定质量的某种金属和等体积盐酸反应速率快慢的影响因素有哪些?
下表为锌粒与等体积稀盐酸溶液反应的实验数据:
组别 | 稀盐酸溶 液的浓度 | 反应开始时酸溶液的温度 | 反应开始到2分钟产生的气体体积 | 反应结束共产生气体体积 |
第一组 | 5% | 20℃ | 10 mL | 60 mL |
10% | 20℃ | 19 mL | 118 mL | |
15% | 20℃ | 28 mL | 175 mL | |
第二组 | 5% | 35℃ | 28 mL | 60 mL |
10% | ____ | 72 mL | 118 mL | |
15% | 35℃ | 103 mL | 175 mL |
(实验分析)
(1)分析实验数据得出:通过比较____可知盐酸溶液浓度是影响金属和酸反应快慢的因素;通过比较_______可知反应时溶液温度是影响金属和酸反应快慢的因素。
(2)可以通过比较______来确定金属和酸的反应速率。
(3)写出该反应的化学方程式________。
(反思评价)
(1)过量锌粒加入到稀盐酸中,反应开始的一段时间,反应速率逐渐加快,而不是逐渐减慢。请分析原因_____________。
(2)小丽设计了如图2所示实验装置用以测定一定量锌粒和稀盐酸反应产生气体的体积。请你分析图2与图1所示装置比较,其优点是___________。
【答案】35 ℃ 每组内的三个实验数据 第一组和第二组的实验数据 相同时间内产生的气体体积的(或反应开始到2分钟产生的气体体积)快慢(或速率) Zn+2HCl= ZnCl2+H2↑ 温度对反应速率的影响大于盐酸溶液浓度对反应速率的影响 在密闭容器内反应更加环保
【解析】
分析比较实验数据可知,每组内相同的是温度,不同的是盐酸的浓度,因此第二组空白处应为35 ℃。【实验分析】(1)根据实验数据可知盐酸浓度越大,在2分钟内产生气体越多,说明反应速度越快,所以金属与酸反应速度快慢与盐酸溶液的浓度有关;在盐酸浓度相同时,温度越高,产生气体越多,说明金属与酸反应速度快慢与温度有关。(2)可以通过比较反应开始到2分钟产生的气体体积(或相同时间内产生的气体体积)来确定金属和酸反应的快慢。 【反思评价】(1)由于金属与酸反应放出热量,溶液温度升高,温度对反应速率的影响大于盐酸溶液浓度对反应速率的影响,所以过量锌粒加入盐酸中,反应开始的一段时间,反应速率逐渐加快,而不是逐渐减慢。(2)实验2的优点是在密闭容器内反应更加环保。

【题目】经过监测和治理,我省的土壤质量已经得到了很好的改善,但个别地区仍然存在盐碱地。某校化学兴趣小组的同学们为此开展了实践活动,他们采集了本地的土样,并对土样围绕两个问题进行探究。
查阅资料
①枸杞和合欢均可在轻度盐碱地中生存。
②盐碱地显碱性。
③该土样中的可溶性物质只含NaCl,CaCl2和Na2CO3。
探究过程
(1)甲组探究土样的酸碱度
具体操作是 ,由此得出,该土样的pH>7。
(2)乙组探究土样的成分(如图所示)
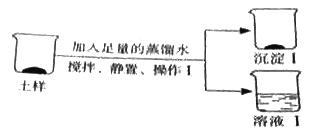
向土样中加入足量的蒸馏水,发生反应的化学方程式 。
同学们对溶液I中的溶质成分很感兴趣,作出如下猜想:
猜想一:只含NaCl
猜想二:含NaCl、CaCl2
猜想三:含NaCl、Na2CO3
设计实验,继续探究:
验证猜想所用试剂 | 实验现象 | 实验结果 | |
方案一 | AgNO3溶液和稀硝酸 | 有白色沉淀生成 | 猜想①正确 |
方案二 | 无明显现象 | 猜想②不正确 | |
方案三 | 猜想③正确 |
反思与评价:
①通过交流,甲组认为乙组的方案一不太严谨,理由是 。
②同学们对沉淀 CaCO3的来源展开了热烈的讨论。一致认为 CaCO3也可能来自土样本身。请解释土样中存在 CaCO3的原因 。
总结与提升:
改良我省的盐碱地,充分利用土地资源,造福山西人民,我们任重而道远。以下建议你认为正确的是
A.轻度盐碱地可以种植枸杞
B.可以用熟石灰改良盐碱地
C.盐碱地应避免施用碱性化肥