题目内容
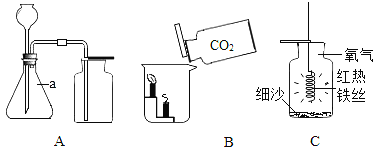
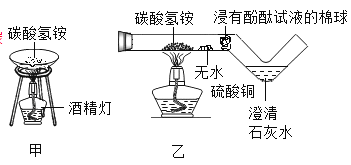
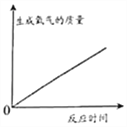
【题目】(2017石家庄新华区模拟)实验是进行科学探究的重要方式。某同学设计如图所示实验,制取二氧化碳并探究其性质,请回答有关问题。
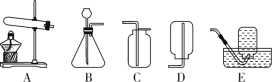
(1)实验室用稀盐酸与石灰石反应制取二氧化碳,应选用的装置是________(填编号);其中此发生装置也可以用来产生O2,该反应的化学方程式为____________。
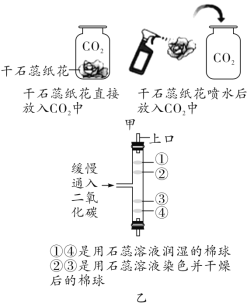
(2)实验甲用了科学探究中的控制变量法,该实验控制的变量是________。干石蕊纸花喷水后放入二氧化碳中,观察到纸花由紫变红,该反应的化学方程式是_____________。
(3)实验乙是在实验甲的基础上设计的创新改进实验,将二氧化碳缓慢通入竖直放置的玻璃管中,能观察到第________(填序号)号棉球先变色。
【答案】B  水
水 ![]() ④
④
【解析】
略

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
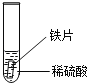
导学与测试系列答案【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜(Cu(OH)2![]() CuO+X),于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
CuO+X),于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为____。
(2)小明在加热氢氧化铜时,发现蓝色固体先变成黑色,继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成分,进行了如下的探究:
(查阅资料)Cu和Cu2O均为红色固体,且Cu2O+H2SO4=Cu+CuSO4+H2O。
(提出猜想)红色固体是:Ⅰ.Cu;Ⅱ.Cu2O;Ⅲ. ____。
(进行实验)
操作 | 现象 | 结论 |
①取灼烧后的红色固体1.44 g于试管中,加入足量稀硫酸,加热并充分振荡,静置 | 溶液由无色变蓝色,固体减少 | 1.44 g红色固体一定有__ |
②过滤、洗涤、干燥 | 得红色固体 |
(结论分析)
①根据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想__也有相同现象。
②氧化铜高温灼烧由黑色变成红色的化学反应方程式为____。
③如要确定1.44 g红色固体成分,还需要补充的操作是__,再通过____得出结论。
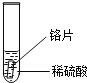
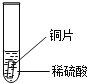
【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加.
[知识回放]
金属活动性顺序:K Ca Na Mg Al Zn Sn Pb(H) Hg Ag Pt Au,请你在横线上填写对应金属的元素符号.
[作出猜想]
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是 .
[查阅资料]
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
[设计实验]
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
实验 | 试管1 | 试管2 | 试管3 |
实验 操作 |
|
|
|
实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 |
|
[结论与解释]
(1)小聪得到的结论是猜想 正确.
(2)实验前用砂纸打磨金属片的目的是 .
[知识运用]
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式 .
【题目】某校化学兴趣小组进行了有关影响金属和酸反应的影响因素的实验探究。
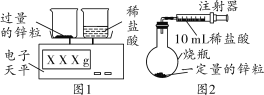
小亮设计了如下实验(如图1):发现随着反应的进行,产生气体的速度逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应过程中,溶液的温度也先随之升高,最后下降到室温。
(提出问题)一定质量的某种金属和等体积盐酸反应速率快慢的影响因素有哪些?
下表为锌粒与等体积稀盐酸溶液反应的实验数据:
组别 | 稀盐酸溶 液的浓度 | 反应开始时酸溶液的温度 | 反应开始到2分钟产生的气体体积 | 反应结束共产生气体体积 |
第一组 | 5% | 20℃ | 10 mL | 60 mL |
10% | 20℃ | 19 mL | 118 mL | |
15% | 20℃ | 28 mL | 175 mL | |
第二组 | 5% | 35℃ | 28 mL | 60 mL |
10% | ____ | 72 mL | 118 mL | |
15% | 35℃ | 103 mL | 175 mL |
(实验分析)
(1)分析实验数据得出:通过比较____可知盐酸溶液浓度是影响金属和酸反应快慢的因素;通过比较_______可知反应时溶液温度是影响金属和酸反应快慢的因素。
(2)可以通过比较______来确定金属和酸的反应速率。
(3)写出该反应的化学方程式________。
(反思评价)
(1)过量锌粒加入到稀盐酸中,反应开始的一段时间,反应速率逐渐加快,而不是逐渐减慢。请分析原因_____________。
(2)小丽设计了如图2所示实验装置用以测定一定量锌粒和稀盐酸反应产生气体的体积。请你分析图2与图1所示装置比较,其优点是___________。