题目内容
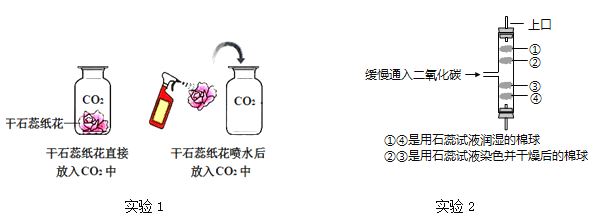
【题目】某化学活动兴趣小组用如图装置进行一氧化碳还原氧化铜的探究实验,反应一段时间后,玻璃管内黑色粉末全部变成红色,澄清石灰水变浑浊。

(1)加热试管前要先通一段时间一氧化碳的目的是__________________。
(2)从安全环保的角度考虑,上述实验需要改进的是需要__________________。
(3)装置 B 中发生反应的化学方程式为________________。
(4)同学们通过查阅资料得知:氧化亚铜(Cu2O)和铜均为红色固体,且 Cu2O能和稀硫酸反应,反应的化学方程式为:![]() 。他们对反应后玻璃管中的红色固体进行如下探究:
。他们对反应后玻璃管中的红色固体进行如下探究:
(提出问题)反应后生成的红色固体成分是什么?
(作出猜想)猜想一:红色固体只有 Cu
猜想二:红色固体只有 Cu2O
猜想三:红色固体可能含有__________。
(实验探究)设计如下实验方案
实验操作 | 现象 | 结论 |
取 1.44g 红色固体于试管中,加入过量的____________。 | _______________ | 红色固体含有Cu2O |
(思考与分析)甲同学认为猜想二正确,同学们分析后认为他的结论不准确,理由是______________。为此,同学们补充进行了以下实验: 将试管中所得红色固体过滤、洗涤、干燥、称量,通过__________来确定猜想二或三正确。
【答案】排净试管内空气(防止不纯 一氧化碳加热爆炸) 尾气处理装置(需要防止一氧化碳污染空气) ![]() Cu2O 和 Cu 稀硫酸 固体部分溶解,溶液由无色变蓝色 铜和氧化亚铜的混合物与硫酸反应,溶液变蓝色,有红色固体剩余(或猜想三也有相同的现象)(合理即可) 计算对比
Cu2O 和 Cu 稀硫酸 固体部分溶解,溶液由无色变蓝色 铜和氧化亚铜的混合物与硫酸反应,溶液变蓝色,有红色固体剩余(或猜想三也有相同的现象)(合理即可) 计算对比
【解析】
(1)一氧化碳与氧气混合加热可能发生爆炸,加热试管前要先通一段时间一氧化碳的目的是排净试管内空气(防止不纯一氧化碳加热爆炸);
(2)一氧化碳有毒不能直接排放到空气中,从安全环保的角度考虑,上述实验需要改进的是需要尾气处理装置(需要防止一氧化碳污染空气);
(3)二氧化碳与氢氧化钙反应生成碳酸钙和水,装置 B 中发生反应的化学方程式为![]() 。
。
(4)黑色固体全部变成红色,氧化铜是黑色,说明没有氧化铜,所以生成的红色固体可能是铜,可能是氧化亚铜,也可能是铜和氧化亚铜的混合物,所以猜想三:红色固体可能含有:Cu和Cu2O的混合物;氧化亚铜和硫酸反应生成硫酸铜、铜和水,所以
实验操作 | 现象 | 结论 |
取 1.44g 红色固体于试管中,加入过量的稀硫酸 | 固体部分溶解,溶液由无色变蓝色 | 红色固体含有Cu2O |
思考与
甲同学认为猜想二正确,同学们分析后认为他的结论不准确,理由是铜和氧化亚铜的混合物与硫酸反应,溶液变蓝色,有红色固体剩余;同学们补充进行了以下实验:将试管中所得红色固体过滤、洗涤、干燥、称量,通过计算氧化亚铜的质量对比来确定猜想二或三正确。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】如图所示装置进行实验(图中铁架台等仪器均已略去)。在I中加入试剂后,塞紧橡皮塞,立即打开止水夹,II中有气泡冒出;一段时间后关闭止水夹,II中液面上升,溶液由无色变为浑浊。符合以上实验现象的I和II中应加入的试剂是
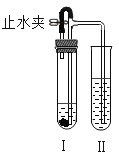
A | B | C | D | |
I | 大理石、稀盐酸 | 紫铜、稀硫酸 | 锌粒、稀盐酸 | 纯碱、稀硫酸 |
II | 硝酸钾溶液 | 氢氧化钡溶液 | 硝酸银溶液 | 氯化钠溶液 |
A.AB.BC.CD.D