��Ŀ����
����Ŀ����ѧ���о�������ɡ��ṹ�����ʼ���仯���ɵĻ�����Ȼ��ѧ����ش�
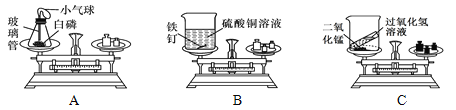
��1������ɽǶȿ����Ȼ������� ��ɣ�
��2�������Ƕȿ����Ȼ������� ���ɣ��������ű�ʾ����
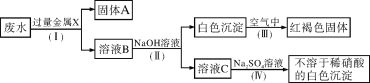
��3�����Ʊ��Ƕȿ�������ˮ���� �ɵõ����Σ���ȥ�����к��е�SO42����Ca2+��Mg2+�����ʣ��������������Na2CO3��Һ����BaCI2��Һ����NaOH��Һ�������Լ��ļ���˳��Ϊ ������ţ���̼���ƺ����ᷴӦҺ�������Ȼ��ƣ���ҵ�ϲ��ô˷�Ӧ�Ʊ��Ȼ��Ƶ�ԭ���� ��
��4���ӱ仯�Ƕȿ������Ȼ��ƺ�ˮ��ͨ�������·�Ӧ������һ�ּ������������CI2�����÷�Ӧ�Ļ�ѧ����ʽΪ �����л�ѧ��Ӧ��Ϊ���࣬һ������Ԫ�صĻ��ϼ������Ļ�ѧ��Ӧ��������ԭ��Ӧ����һ���Ƿ�Ӧǰ��Ԫ�ػ��ϼ۶�û�иı���Ƿ�������ԭ��Ӧ���ݴ��ж�������Ӧ������Ϊ ��
���𰸡���1����Ԫ�غ���Ԫ�� ��2��Na+��Cl��
��3�������ᾧ���ڢۢ����ۢڢ����ڢ٢���̼���ơ�����ijɱ����Ȼ��Ƹ�
��4��2NaCl+2H2O![]() Cl2��+H2��+2NaOH��������ԭ��Ӧ��
Cl2��+H2��+2NaOH��������ԭ��Ӧ��
��������
�����������1������ɽǶȿ��Ȼ���������Ԫ�غ���Ԫ����ɣ�
��2�������Ƕȿ��Ȼ������������Ӻ������ӹ��ɣ�
��3���Ȼ��Ƶ��ܽ�����¶�Ӱ��仯�������Դ��Ʊ��Ƕȿ�������ˮ���������ᾧ�ɵõ����Σ�NaOH��Һ��þ���ӡ�BaCI2��Һ��ȥ��������ӡ���Na2CO3��ҺΪ�˳�ȥ�������Լ������ı����ӣ����Գ������������Na2CO3��Һ����BaCI2��Һ����NaOH��Һ�������Լ��ļ���˳��Ϊ�ڢۢ����ۢڢ����ڢ٢���̼���ƺ����ᷴӦҺ�������Ȼ��ƣ���ҵ�ϲ��ô˷�Ӧ�Ʊ��Ȼ��Ƶ�ԭ����̼���ơ�����ijɱ����Ȼ��Ƹߣ�
��4���Ȼ��ƺ�ˮ��ͨ�������·�Ӧ�������������ơ��������������÷�Ӧ�Ļ�ѧ����ʽΪ2NaCl+2H2O![]() Cl2��+H2��+2NaOH���÷�Ӧ����Ԫ�صĻ��ϼ��ɩ�1�۱�Ϊ0�ۣ�����Ԫ�صĻ��ϼ���+1�۱�Ϊ0�ۣ���������������ԭ��Ӧ��
Cl2��+H2��+2NaOH���÷�Ӧ����Ԫ�صĻ��ϼ��ɩ�1�۱�Ϊ0�ۣ�����Ԫ�صĻ��ϼ���+1�۱�Ϊ0�ۣ���������������ԭ��Ӧ��

����Ŀ���о���ѧϰС��ѡ����H2O2����O2�Ŀ�����ʲô�����й����Ŀ������̽��������������̽������Ҫ���̣�
���裺H2O2����O2�Ŀ�������������й�
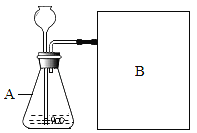
ʵ�鷽���������£�����ƿ��ͬ�����H2O2��Һ�зֱ������ͬ����MnO2�ͺ�ש�ۣ�����������һƿ(��ͬ���)O2����Ҫ��ʱ�䣮
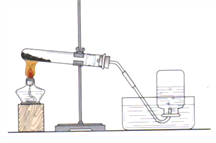
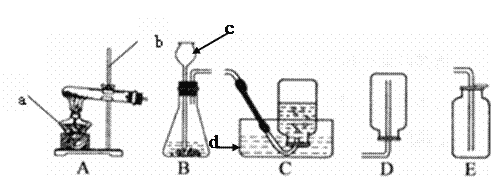
����ʵ�飺��ͼ�����ǽ���ʵ���װ��ͼ����ʵ����B���˲��õ������ռ������ǣ�_____��
ʵ���¼��
ʵ���� | 1 | 2 |
��Ӧ�� | 6% H2O2 | 6% H2O2 |
���� | 1g ��ש�� | 1g MnO2 |
ʱ�� | 152s | 35s |
���ۣ���̽�����̵ó��Ľ�����_____��
��˼��H2O2�ڳ����·ֽ��������MnO2�� ��ש�ۺ�Ӧ���Լӿ죬��Ҫ֤��MnO2�� ��ש���Ǹ÷�Ӧ�Ĵ���������Ҫ����ʵ������֤�����ڻ�ѧ��Ӧǰ���_____��_____�Ƿ�ı䣮
����Ŀ��t��ʱ��NaCl������ˮ��ʵ���������±���ʾ������˵����ȷ����( )
ʵ����� | ˮ��������g | ����NaCl��������g | ��Һ��������g |
�� | 10 | 2 | 12 |
�� | 10 | 3 | 13 |
�� | 10 | 4 | 13.6 |
�� | 10 | 5 | 13.6 |
A. ʵ��ڢۢܵõ����DZ�����Һ B. ʵ������ʵ���������Ϊ36%
C. t��ʱ��10gˮ�п����ܽ�4gNaCl D. t��ʱ��NaCl ���ܽ��Ϊ36g
����Ŀ�����39-A��39-B��������ѡ1����������������𣬰�39-A�Ʒ֡�
39-A | 39-B |
|
|
(1)̼��ƵĻ�ѧʽΪ________�� (2)ÿƬ��Ƭ�и�300 mg�����ü���ʽ��ʾ��������_____________�� | (1)���������Ļ�ѧʽΪ________�� (2)ij���˰���˵�����ҩ1�죬�ɲ�����Ԫ��________mg�� |