题目内容
【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
假设:H2O2生成O2的快慢与催化剂种类有关
实验方案:常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间.
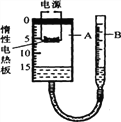
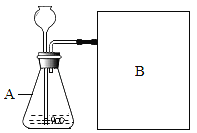
进行实验:如图是他们进行实验的装置图,此实验中B处宜采用的气体收集方法是:_____.
实验记录:
实验编号 | 1 | 2 |
反应物 | 6% H2O2 | 6% H2O2 |
催化剂 | 1g 红砖粉 | 1g MnO2 |
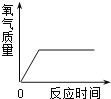
时间 | 152s | 35s |
结论:该探究过程得出的结论是_____.
反思:H2O2在常温下分解缓慢,加入MnO2或 红砖粉后反应明显加快,若要证明MnO2和 红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____和_____是否改变.
【答案】 排水集气法 在相同条件下,H2O2生成O2的快慢与催化剂种类有关 质量 化学性质
【解析】收集氧气的方法有两种:向上排空气法和排水法,由于该试液是测量各生成一瓶(相同体积)O2所需要的时间,故应采用排水法收集便于观察是否收集满;由表格数据可知生成等体积的氧气,向等体积等浓度的过氧化氢溶液中加入二氧化锰所需要的时间更短,即在相同条件下,H2O2生成O2的快慢与催化剂种类有关;判断一种物质是否是反应的催化剂,要看它是否具有“一变二不变”的特点,即能改变物质的反应速率,但反应前后本身的质量和化学性质不变,该实验中只证明了MnO2和 红砖粉能加快过氧化氢的分解速率,但没有探究化学反应前后MnO2和 红砖粉的质量和化学性质是否改变,故要证明MnO2和 红砖粉是反应的催化剂,要对MnO2和 红砖粉的质量和化学性质进行探究。

【题目】几位同学对蜡烛燃烧火焰的焰心进行了以下探究。

请你完成其中的一些步骤:
(1)点燃蜡烛,将一根小木条迅速平放入火焰中,约1 s 后取出,现象如上图中甲所示,这证明焰心__________________。
(2)向焰心斜向插入一支细短玻璃管,发现玻璃管中无明显现象(如图乙),在玻璃管的上口点燃,上口产生火焰,这说明焰心物质的性质是____________、____________。
(3)猜想和验证
猜想 | 操作 | 现象 | 结论 |
假设①:焰心气体含二氧化碳 | 在未点燃的短玻璃管上口_______________________ | ________ | 假设①不成立 |
假设②:焰心气体含有石蜡蒸气 | 取一较长的细玻璃管,用湿冷毛巾包住中部,将玻璃管下端插入焰心,上端试用火焰点燃 | __________ | 假设②成立 |
取下长玻璃管,打开湿毛巾 | ____________ |
(4)若蜡烛的主要成分是石蜡,则其燃烧反应的文字表达式为______________________。