题目内容
【题目】某化工厂排出的废水透明、澄清、略显蓝色。一同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成。过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,产生蓝色沉淀。试回答:
(1)用化学式回答:加入过量的盐酸,生成的白色沉淀是__________;生成的蓝色沉淀是________。
(2)废水中一定含有的物质是__________(填编号)。
A.氯化物 B.硫酸盐 C.硝酸盐 D.碳酸盐
(3)该同学设计了一个从废水中除去重金属离子的实验方案如下[已知白色的Fe(OH)2固体在潮湿的空气中可生成红褐色的Fe(OH)3]:
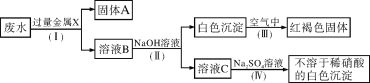
①金属X为__________,固体A中一定含有的物质为__________(写化学式)。
②B溶液中的溶质一定含有__________和__________(填字母)。
A.K2CO3 B.Fe(NO3)2 C.MgCl2 D.Ba(NO3)2
③第Ⅳ步反应的化学方程式为:___________________________。
【答案】(1)AgCl Cu(OH)2(2)C
(3)①Fe、Ag和Cu②B D③Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3、
【解析】
试题分析:加入过量的盐酸,生成的白色沉淀是AgCl,因为盐酸盐中只有氯化银是沉淀;生成的蓝色沉淀是Cu(OH)2 ,废水中一定含有的物质是硝酸盐,因为原来的溶液是澄清,如果是另外三者的话均得到沉淀, 实验中最后得到红褐色的固体,说明沉淀是氢氧化铁,所以溶液B中含有铁元素,说明X是铁,铁的活动性大于铜和银,所以A中一定有Ag和Cu,溶液B中含有铁离子才能最终得到氢氧化铁沉淀,所以一定含有Fe(NO3)2,而加入硫酸钠后还能得到不溶于硝酸的沉淀,说明B还含有Ba(NO3)2。

 阅读快车系列答案
阅读快车系列答案