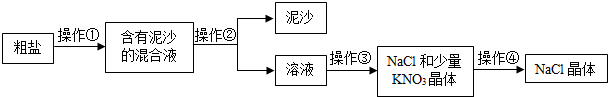
题目内容
某校研究性学习小组的同学设计了简单的实验方案,验证呼出的气体与吸入空气成分的含量有什么不同,其主要操作步骤如表所示:请填写验证依据.
| 实验步骤 | 验证依据 |
| (1)取两个空集气瓶,用玻璃片将瓶口盖好,这样两瓶空气样品就收集好了. |  |
| (2)取另外两个集气瓶,用排水法收集两瓶人呼出的气体. | |
| (3)将燃着的小木条分别插入空气样品和呼出气体的样品中. | 根据 判断 |
| (4)向一瓶空气样品和一瓶呼出气体的样品中各滴入相同滴数的澄清石灰水,振荡. | 根据 判断 |
| (5)取两块干燥的玻璃片或镜片,对着其中一块哈气,对比观察. | 根据 判断 |
考点:吸入空气与呼出气体的比较,常见气体的检验与除杂方法
专题:科学探究
分析:人呼吸时把空气中的氧气转化为二氧化碳,同时从体内带出水蒸汽,人体呼出气体和空气中的氧气、二氧化碳、水蒸汽含量不同;氮气的含量基本不变,因为人体没有吸收氮气;呼出的气体与吸入空气相比,具有“两多一少”的特点,即与吸入的空气相比,二氧化碳、水蒸气含量增加,氧气含量减少;据此结合常见气体的检验方法进行分析解答即可.
解答:解:(3)氧气能支持燃烧,将燃着的木条分别插入空气样品和呼出气体的样品中,插入呼出气体中的木条立即熄灭,说明呼出的气体中氧气含量比空气中的少.
(4)二氧化碳能使澄清的石灰水变浑浊,向一瓶空气样品和一瓶呼出气体的样品中各滴入相同滴数的澄清石灰水,振荡,呼出气体中的澄清石灰水变浑浊,说明呼出的气体中二氧化碳含量比空气中的多.
(5)取两块干燥的玻璃片或镜片,对着其中一块哈气,对比观察,对着呼气的玻璃片上有水雾出现,说明呼出的气体中水蒸气含量比空气中的多.
故答案为:
(4)二氧化碳能使澄清的石灰水变浑浊,向一瓶空气样品和一瓶呼出气体的样品中各滴入相同滴数的澄清石灰水,振荡,呼出气体中的澄清石灰水变浑浊,说明呼出的气体中二氧化碳含量比空气中的多.
(5)取两块干燥的玻璃片或镜片,对着其中一块哈气,对比观察,对着呼气的玻璃片上有水雾出现,说明呼出的气体中水蒸气含量比空气中的多.
故答案为:
| 实验步骤 | 验证依据 |
| (1)取两个空集气瓶,用玻璃片将瓶口盖好,这样两瓶空气样品就收集好了. |  |
| (2)取另外两个集气瓶,用排水法收集两瓶人呼出的气体. | |
| (3)将燃着的小木条分别插入空气样品和呼出气体的样品中. | 根据 燃着的木条是否熄灭的现象, 判断 氧气含量不同 |
| (4)向一瓶空气样品和一瓶呼出气体的样品中各滴入相同滴数的澄清石灰水,振荡. | 根据 澄清石灰水是否变浑浊的现象, 判断 二氧化碳含量不同 |
| (5)取两块干燥的玻璃片或镜片,对着其中一块哈气,对比观察. | 根据 玻璃片上是否有水雾出现的现象, 判断 水蒸气含量不同 |
点评:本题难度不大,了解人体吸入的空气与呼出的气体成分的区别、常见气体的检验方法是正确解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
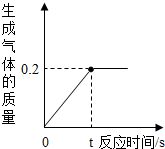 化学兴趣小组的同学取10g某锌样品(含少量杂质,且杂质不溶于水,也不与酸反应)于烧杯中,向其中加入一定量的稀硫酸,当加入稀硫酸的质量为93.7g时,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
化学兴趣小组的同学取10g某锌样品(含少量杂质,且杂质不溶于水,也不与酸反应)于烧杯中,向其中加入一定量的稀硫酸,当加入稀硫酸的质量为93.7g时,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.