题目内容
【题目】实验室有一包白色粉末,可能由Na2SO4、Na2CO3、CuSO4、NaOH、BaCl2中的一种或几种组成。为探究其组成设计并进行了以下实验:
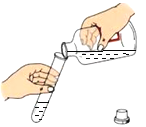
步骤一:取少量白色粉末于烧杯中,加入足量的水溶解,并用玻璃棒充分溶解,搅拌、过滤,得到无色滤液和白色沉淀。
步骤二:取少量无色滤液于试管中,向其中加入___________,溶液变红。
步骤三:向白色沉淀中加入足量的稀盐酸沉淀全部溶解。
请分析上述实验现象,回答下列问题
(1)白色粉末中一定不含__________,可能含有_____________。
(2)请写出生成白色沉淀的化学方程式_______________。
【答案】酚酞试液 CuSO4、Na2SO4 NaOH Na2CO3+BaCl2=BaCO3![]() +2NaCl
+2NaCl
【解析】
步骤二:取少量无色滤液于试管中,向其中加入酚酞试液,溶液变红;
(1)白色粉末加水溶解得到无色溶液和白色沉淀,所以粉末中一定不含硫酸铜,白色沉淀加入稀盐酸,全部溶解,所以白色粉末中一定含有氯化钡、碳酸钠,一定不含硫酸钠,可能含有氢氧化钠;
(2)生成白色沉淀的反应是碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl。

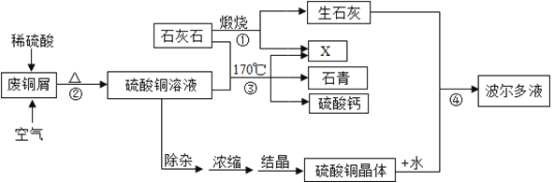
【题目】某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如下:
一、产品制备
(1)流程图中X的化学式为______;
(2)反应②分两步进行,化学方程式分别为:第一步______,第二步______;
(3)硫酸铜的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
蒸发浓缩后热溶液经处理大量析出晶体,温度到达30℃时,剩余硫酸铜溶液的溶质质量分数为______;待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质; Ⅱ是______。
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其总反应化学方程式为______。
二、组成测定
资料:石青的化学式是aCuCO3·bCu(OH)2,已知Cu(OH)2和CuCO3都能受热分解,分别生成两种氧化物,其中Cu(OH)2的分解温度为66℃到68℃,CuCO3的分解温度为200℃到220℃。
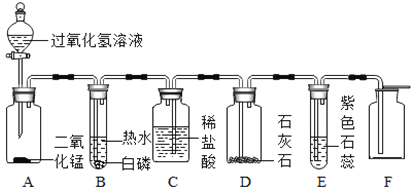
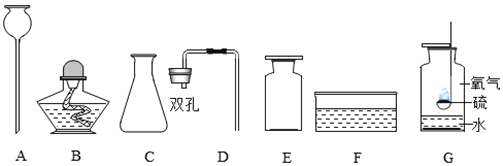
为测定其组成,小组同学称取石青样品34.6g,用下图装置进行实验。

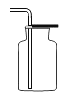
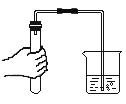
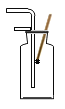
(5)洗气瓶A中氢氧化钠溶液的作用是______;B中所装液体为______。
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g。通过计算可得 a︰b=______。
(7)若缺少F装置,测得的a︰b的值会______(选填“偏大”、“偏小”、“不变”)。
三、产物探究
取22.2g样品,对固体进行热分解实验,测定剩余固体质量与分解温度之间关系如图。请回答下列问题:
(8)0~66℃固体质量没有发生变化的原因可能是_______。
(9)m=________。
(10)若将mg剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:______。