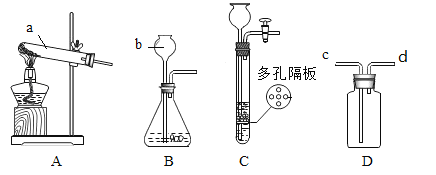
题目内容
【题目】掌握科学的研究方法,探索化学世界的奥秘。
(1)分类是学习化学的重要方法之一。
生活中,常会接触到下列物质:A.铜丝 B.天然气 C.干冰 D.食盐水
其中属于混合物的是(填字母,下同)_____________,属于氧化物的是____________。
(2)控制变量,设计对比实验是实验探究的重要方法。_______、________、_________

(3)质量守恒定律是帮助我们学习和认识化学反应实质的重要理论。
①下列表述正确的是_________。
A.蜡烛燃烧后质量减少,说明质量守恒定律不是普遍规律
B.每32gS和32gO2完全反应后,生成64gSO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②物质X是一种可再生绿色能源,其燃烧的化学方程式为X+3O2![]() 2CO2+3H2O,则X的化学式为__________。
2CO2+3H2O,则X的化学式为__________。
【答案】 BD C 澄清石灰水体积(或澄清石灰水滴数) 温度 O2含量越高,反应越剧烈 B C2H5OH(或C2H6O)
【解析】根据所学知识和题中信息知,(1)分类是学习化学的重要方法之一。属于混合物的是B.天然气和D.食盐水。属于氧化物的是C.干冰。(2)控制变量,设计对比实验是实验探究的重要方法。实验分析∶还要控制澄清石灰水体积(或澄清石灰水滴数)。②影响分子运动快慢的因素是温度。结论是O2含量越高,反应越剧烈 。 (3)质量守恒定律是帮助我们学习和认识化学反应实质的重要理论。①下列表述正确的是∶A.蜡烛燃烧后质量减少,生成了气体和水,质量守恒定律是普遍规律。故A错误。B.每32gS和32gO2完全反应后,生成64gSO2 。故B正确。C.在化学反应aA+bB=cC+dD中不一定有:a+b=c+d。故D错误。
点睛∶本题主要考查)分类法,控制变量,质量守恒定律等知识。

【题目】黄铜是铜锌合金,为测定黄铜中铜的质量分数,在分别在甲、乙,丙三个烧杯中加入一定量的黄铜粉,再加入一定量的稀硫酸,充分反应后,烧杯内的物质质量如下表:
甲 | 乙 | 丙 | |
加入黄铜粉的质量(g) | 32.5 | 32.5 | 36.5 |
加入稀硫酸的质量(g) | 40 | 50 | 40 |
烧杯内物质的质量(g) | 72.3 | 82.3 | 76.3 |
求:
(1)甲烧杯中,完全反应后生成氢气的质量 克?
(2)黄铜中铜的质量分数?
(3)所加硫酸中溶质的质量分数?