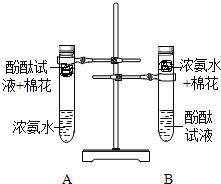
题目内容
【题目】某锥形瓶中盛有一定量的盐酸和氯化铜的混合溶液,向其中逐滴加入溶质质量分数为10.0% 的氢氧化钠溶液,锥形瓶内溶液的质量与滴入的氢氧化钠溶液的质量的变化关系如图所示.请计算:
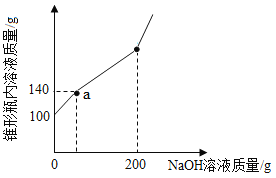
(1)a点的坐标为_________。
(2)计算原锥形瓶盛有的混合溶液中氯化铜的质量分数______。
【答案】(40 , 140) 27.0 %
【解析】
(1)向一定量的盐酸和氯化铜的混合溶液中逐滴加入溶氢氧化钠溶液,则氢氧化钠先与盐酸反应生成氯化钠和水,由图可知,a点时氢氧化钠与盐酸恰好完全反应,消耗的氢氧化钠溶液的质量为140g100g=40g,则a点的横坐标为40,纵坐标就是反应的氢氧化钠溶液质量与原混合溶液的质量和的质量数,即140,故填(40 , 140)。
(2)解:与氯化铜反应的氢氧化钠的质量为(200g40g)×10.0%=16g
设参加反应的氯化铜的质量为x
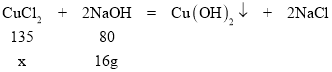
![]() =
=![]()
x=27g
原锥形瓶盛有的混合溶液中氯化铜的质量分数为![]() ×100%=27%
×100%=27%
答:原锥形瓶盛有的混合溶液中氯化铜的质量分数为27%。

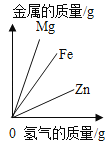
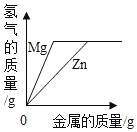
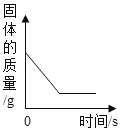
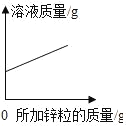
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D
【题目】研究小组设计下列实验方案探究CO2与NaOH溶液是否发生反应。
方案一:
[查阅资料]
①乙醇不与NaOH、Na2CO3、CO2反应;
②25℃时,NaOH和Na2CO3在乙醇中的溶解度如下表:
物质 | NaOH | Na2CO3 |
溶解度/g | 17.3 | <0.01 |
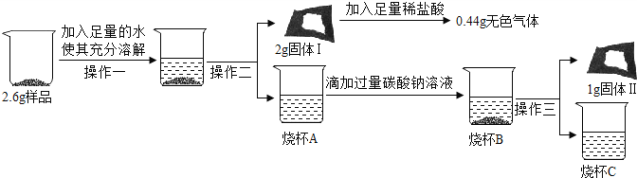
[实验装置] 如图1。
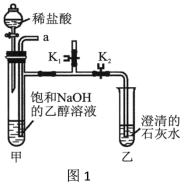
[实验步骤]
i.打开K1,关闭K2,从导管口a通入CO2气体,直至观察到饱和NaOH的乙醇溶液中产生大量沉淀,停止通CO2;
ii.从导管口a通入足量氮气;
iii.关闭K1,打开K2,向装置甲的试管中滴入足量的稀盐酸,观察装置乙的现象。
(1)步骤i产生沉淀的原因是___________________。
(2)步骤ii的目的是____________________。
(3)步骤iii装置乙中产生现象的原因是__________(用化学方程式表示)。
方案二:
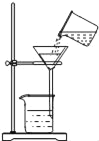
[实验装置]
如图2(三颈瓶内集满CO2气体;装药品后的注射器B的活塞用夹子固定)。
[实验步骤]
按以下步骤完成实验,通过相对压强传感器测量瓶内压强的变化。整个实验过程的压强随时间变化如图3。
i.将注射器A内的NaOH溶液注入瓶中,测量压强直至不再改变;
ii.取下夹子,将注射器B内的盐酸注入瓶中,测量压强直至不再改变;
iii.将两个注射器的活塞都拉回原位,并都用夹子固定,测量压强直至不再改变。

(4)检查图2装置气密性的方法:____________。
(5)为缩短①→④中反应的时间,可采取的操作是______________。
(6)写出导致⑤→⑥压强变化的主要反应的化学方程式:________。
(7)步骤iii结束后瓶内压强比注入NaOH溶液前小,其原因是__________。
(8)请结合图3信息,说明NaOH与CO2发生了反应。_________。