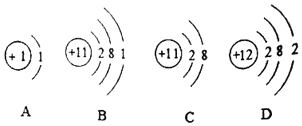
题目内容
【题目】某食品包装袋中“双吸剂”标签如表所示:
品名:双吸剂
成分:铁粉、生石灰
化学兴趣B组的同学们对这包久置的“双吸剂”样品很感兴趣,设计了下列实验进行探究。
(提出问题)久置的“双吸剂”固体的成分是什么?
(查阅资料)常温下,铁能与氯化铁溶液反应生成氯化亚铁。
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3
(定性研究)
(1)小明取少量样品放入试管中,加入一定量的稀盐酸,观察到试管中的固体质量逐渐减少,生成了一种能使澄清石灰水变浑浊的气体,得到了浅绿色的溶液。小明初步判断:样品中一定含有_____(填化学式),一定不含Fe2O3
(实验质疑)
(2)兴趣小组的同学们讨论后认为上述实验并不能得出一定不含Fe2O3的结论,理由是:_____、_____(用化学方程式表示)。为了进一步确定这包久置的“双吸剂”固体的成分,同学们继续进行如下定量实验。
(定量研究)
(3)取3.0g样品研碎,并用磁铁充分吸收后,得到剩余固体2.6g,按照下列流程进行实验:
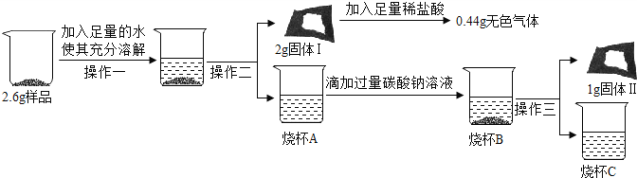
①操作二和操作三的名称为_____。
②固体I的成分是_____(填化学式)。
③写出生成固体Ⅱ的化学方程式:_____。
(得出结论)
(4)根据定性、定量研究中的现象和数据分析判断,这包久置的“双吸剂”固体的成分为_____(填化学式)。
(实验反思)
(5)结合上述的实验,下列说法不正确的是_____(不定项选择)。
A 对物质成分的研究有时需要定性和定量相结合
B 在原样品中加入足量的稀盐酸后有4个反应发生
C (定量研究)烧杯C中的溶质为NaOH和Na2CO3
D (定量研究)3.0g样品中氢氧化钙的质量小于0.10g
【答案】CaCO3、Fe Fe2O3+6HCl=2FeCl3+3H2O Fe+2FeCl3=3FeCl2 过滤 CaCO3和Fe2O3 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH Fe、Fe2O3、CaO、Ca(OH)2、CaCO3 AC
【解析】
(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,铁和盐酸反应生成氯化亚铁和氢气,所以取少量样品放入试管中,加入一定量的稀盐酸,发现:试管中固体质量逐渐减少,生成一种能使澄清石灰水变浑浊的气体,得到浅绿色溶液,初步判断:样品中一定含有CaCO3、Fe,一定不含Fe2O3;
(2)氧化铁和盐酸反应生成氯化铁和水,氯化铁和铁反应生成氯化亚铁,所以上述实验并不能得出一定不含Fe2O3的结论,理由是:Fe2O3+6HCl=2FeCl3+3H2O,Fe+2FeCl3=3FeCl2;
(3)①过滤可以将不溶性固体从溶液中分离出来,所以操作二、操作三的名称是过滤;
②取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,所以已经出去了铁粉,溶解过滤的固体Ⅰ的质量为2g,其中含有碳酸钙还可能有氧化铁,设生成0.44g二氧化碳需要碳酸钙的质量为x,

![]()
x=1g,
由于生成气体0.44g所以固体Ⅰ中含有1g碳酸钙,所以固体Ⅰ中含有CaCO3和Fe2O3;
③氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)由于固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3,能够被磁铁吸引的0.4g固体是铁,剩余的2.6g固体中还可能含有Fe2O3(不溶于水)CaO[能和水反应生成Ca(OH)2]、Ca(OH)2(微溶于水,加足量的水后完全溶解)和CaCO3(不溶于水),剩余的固体Ⅰ中的物质可能为:Fe2O3和CaCO3,溶解的物质为0.6g,所以滤液的成分为Ca(OH)2和碳酸钠反应生成碳酸钙和氢氧化钠,其化学方程式为:
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;又生成沉淀为1g,设生成1g碳酸钙固体所需的氢氧化钙质量为y,
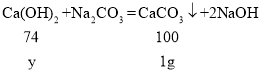
![]()
y=0.74g,
设生成0.74g氢氧化钙需要氧化钙的质量为z,
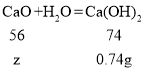
![]()
z=0.56g,
所以滤液中的氢氧化钙有部分是由氧化钙与水反应生成,所以包久置的“双吸剂”固体的成分有:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3;
(5)A、对物质成分的探究有时需要定性与定量实验的结合,故A正确;
B、由固体物质的成分为:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3;五种物质都与盐酸反应,反应个数多于5个,故B错误;
C、由分析中可知实验中氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,溶质有NaOH,由于加入的是过量的碳酸钠溶液,因此里面的溶质还有Na2CO3,故C正确;
D、当3.0g样品中氢氧化钙的质量等于0.10g时,氧化钙的质量为0.6g﹣0.10g=0.5g,设0.5g氧化钙完全反应生成氢氧化钙的质量为m,

![]()
m≈0.66g
故:0.66g+0.1g=0.76g>0.74g,所以D错误。

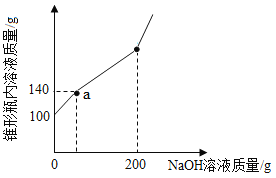
【题目】KCl的溶解度曲线如图所示。在下表对应的温度下,向4只盛有100 g水的烧杯中,分别加入40 g KCl固体,充分溶解。
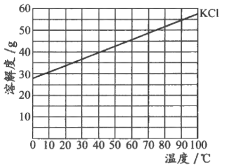
烧杯序号 | ① | ② | ③ | ④ |
温度(℃) | 20 | 30 | 50 | 60 |
下列关于①~④所得溶液的说法不正确的是
A. 溶质质量:①<②
B. 溶液质量:②<③
C. 溶质质量分数:③<④
D. ④中溶质与溶剂的质量比为2: 5