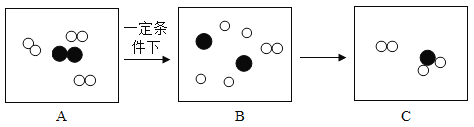
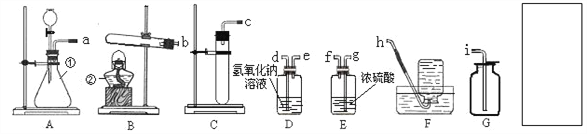
题目内容
【题目】下图是对实验绘制的相关变化的图形,其中实验结果与图形对应准确的是
A.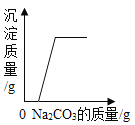 向一定量的稀盐酸和氯化钙的混合溶液中不断加入碳酸钠溶液至过量
向一定量的稀盐酸和氯化钙的混合溶液中不断加入碳酸钠溶液至过量
B.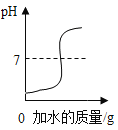 向硫酸中加水,溶液pH的变化
向硫酸中加水,溶液pH的变化
C.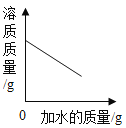 向饱和食盐水中不断加水,溶液中溶质的质量变化
向饱和食盐水中不断加水,溶液中溶质的质量变化
D.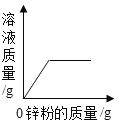 向一定量硫酸铜溶液中不断加入锌粉,溶液的质量变化
向一定量硫酸铜溶液中不断加入锌粉,溶液的质量变化
【答案】A
【解析】
A、向稀盐酸和氯化钙的混合液中加入碳酸钠溶液,则碳酸钠首先与混合液中的盐酸反应,开始没有沉淀生成,等盐酸反应完,碳酸钠与氯化钙反应生成碳酸钙沉淀,故正确;
B、向硫酸中加水,酸性减弱,溶液pH增大,但酸性溶液的pH不会大于7,故错误;
C、向饱和食盐水中不断加水,溶液中溶质的质量不变,故错误;
D、向一定量硫酸铜溶液中不断加入锌粉,每65份质量的锌置换出64份质量的铜,固体质量减小,溶液质量增加,但溶液的质量开始不是0,故错误。
故选A。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%.具体是什么物质无法辨认。老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种。
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是_____。
(2)小亮取少量样品于试管中,滴加_____试液,试液变红色,该溶液不可能是_____(填写化学式),理由是_____。
(3)为了确定该溶液的成分,小亮同学设计了下面的实验:
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
实验一:取少量溶液于试管中,滴加_____ | _____ | 该溶液是碳酸钠溶液。 有关反应的化学方程式为:_____ |
实验二:取少量溶液于试管中,滴加氯化钾溶液 | 产生白色沉淀 | 该溶液是氢氧化钠溶液。 |
(实验反思)你认为实验二的设计是否合理?_____,原因是_____。