题目内容
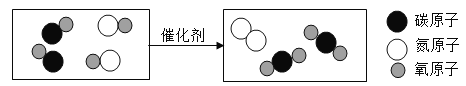
【题目】2011年12月,网上报道某公司非法使用草甘膦转基因大豆。草甘膦(化学式为C3H8NO5P)是一种有机磷除草剂,白色结晶,易溶于水、乙醇等,不可燃,常温下稳定。
计算:(1)草甘膦的相对分子质量为_____;
(2)草甘膦中碳元素与氧元素的质量比为_____;
(3)草甘膦中磷元素的质量分数为_____(精确到0.1%);
(4)33.8g草甘膦中含有_____克磷元素。
【答案】169 9:20 18.3% 6.2
【解析】
解:(1)草甘膦的相对分子质量是12×3+1×8+14+16×5+31=169。
(2)草甘膦中碳元素与氧元素的质量比为(12×3):(16×5)=9:20。
(3)草甘膦中磷元素的质量分数为![]() ×100%≈18.3%。
×100%≈18.3%。
(4)33.8克草甘膦中含有磷的质量为33.8g×![]() ×100%=6.2g。
×100%=6.2g。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】工业上用高温煅烧石灰石制备CO2,某探究小组欲探究煅烧后的固体残留物成分
[资料] ①CaO +2HCl = CaCl2+ H2O ②CaCl2溶液呈中性
(1)高温煅烧石灰石的方程式为___________________,根据化学方程式进行猜想:
猜想一:只有CaO,猜想二:有 CaO和________________
[实验验证]
(2)两位同学设计实验方案如下表
甲同学 方案一 | 乙同学 方案二 | |
实验步骤现象 |
|
|
①据甲同学方案一中现象,可判断剩余固体中一定含有_______,用方程式解释__________。
②乙同学认为猜想二一定正确,该同学的方案是否合理?_______,理由是______________。
③丙同学认为结合方案一和方案二可以判定猜想二成立,该观点____(填“正确”或“不正确”)
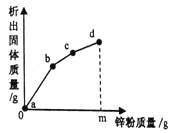
[讨论与反思]小组同学认为,导致残余固体中不止含有一种物质的原因可能是石灰石的状态导致的,为此他们模拟工业操作,在实验室高温煅烧石灰石,相关记录如下表
石灰石(不含杂质) | 状态 | 温度 | 最终收集到CO2的质量 | |
实验1 | 2g | 块状 | 800℃ | 0.748g |
实验2 | 未知 | 粉末状 | 800℃ | 0.876g |
(3)上表中实验1中的产率为___________(产率=实际产物质量÷理论产物质量×100%),为了达成实验目的,实验2中未知质量应该是__________g,
[反思总结]
(4)从表中数据可知,高温煅烧石灰石最好选择_______状态反应更充分,理由是________。
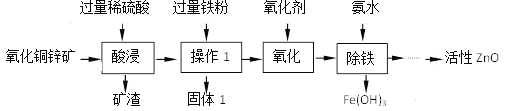
【题目】某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案。部分实验流程如下:
已知:①H2O2、KMnO4是常见的氧化剂
②各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请根据上述实验流程回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是_________,写出硫酸溶解氧化锌的化学方程式为_________________。
(2)“操作1”所需要的主要玻璃仪器有______________________,固体1的成分是___________。
(3)“氧化”的目的是将Fe2+反应生成Fe3+,以便在后续的操作中将溶液中铁元素除去从产品纯度的角度分析,氧化剂最好选用_________________(填“H2O2"或“KMnO4”)。
(4)“除铁”过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在_______范围之间。
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化式__________________。