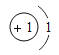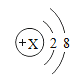��Ŀ����
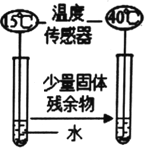
����Ŀ����ҵ���ø�������ʯ��ʯ�Ʊ�CO2��ij̽��С����̽�����պ�Ĺ��������ɷ�
[����] ��CaO +2HCl = CaCl2+ H2O ��CaCl2��Һ������
��1����������ʯ��ʯ�ķ���ʽΪ___________________�����ݻ�ѧ����ʽ���в��룺
����һ��ֻ��CaO����������� CaO��________________
[ʵ����֤]
��2����λͬѧ���ʵ�鷽�����±�
��ͬѧ ����һ | ��ͬѧ ������ | |
ʵ�鲽������ |
|
|
�پݼ�ͬѧ����һ�������ж�ʣ�������һ������_______���÷���ʽ����__________��
����ͬѧ��Ϊ�����һ����ȷ����ͬѧ�ķ����Ƿ������_______��������______________��
�۱�ͬѧ��Ϊ��Ϸ���һ�ͷ����������ж�������������ù۵�____��������ȷ����������ȷ����
[�����뷴˼]С��ͬѧ��Ϊ�����²�������в�ֹ����һ�����ʵ�ԭ�������ʯ��ʯ��״̬���µģ�Ϊ������ģ�ҵ��������ʵ���Ҹ�������ʯ��ʯ����ؼ�¼���±�
ʯ��ʯ���������ʣ� | ״̬ | �¶� | �����ռ���CO2������ | |
ʵ��1 | 2g | ��״ | 800�� | 0.748g |
ʵ��2 | δ֪ | ��ĩ״ | 800�� | 0.876g |
��3���ϱ���ʵ��1�еIJ���Ϊ___________������=ʵ�ʲ������������۲���������100%����Ϊ�˴��ʵ��Ŀ�ģ�ʵ��2��δ֪����Ӧ����__________g��
[��˼�ܽ�]
��4���ӱ������ݿ�֪����������ʯ��ʯ���ѡ��_______״̬��Ӧ����֣�������________��
���𰸡�CaCO3 ![]() CaO+ CO2�� CaCO3 CaO CaO + H2O = Ca��OH��2 �������� ������ֻ���ж���CaCO3����ȷ��CaO�Ƿ���� ��ȷ 85% 2g ��ĩ״�� ����Ӵ������߲��ʣ��ش�������ɣ�
CaO+ CO2�� CaCO3 CaO CaO + H2O = Ca��OH��2 �������� ������ֻ���ж���CaCO3����ȷ��CaO�Ƿ���� ��ȷ 85% 2g ��ĩ״�� ����Ӵ������߲��ʣ��ش�������ɣ�
��������
��1�����������£�̼��Ʒֽ����������ƺͶ�����̼����Ӧ�Ļ�ѧ����ʽΪ��
![]() �����ݻ�ѧ����ʽ���в��룺����һ��ֻ��CaO�����������CaO��CaCO3��
�����ݻ�ѧ����ʽ���в��룺����һ��ֻ��CaO�����������CaO��CaCO3��
��2���ٷ���һ����ˮ�м������ʱ���ȣ�˵��������һ�����������ƣ�������Ϊ�����ƺ�ˮ��Ӧ�����������ƣ����ȣ������¶����ߣ���Ӧ�Ļ�ѧ����ʽΪ��CaO+H2O=Ca(OH)2��
��������м�������ϡ����ʱ���������ݣ�˵�������к���̼��ƣ����Dz���ȷ���Ƿ��������ƣ��ʷ�������������
�����Ͽ�֪����һ����֤��һ�����������ƣ�����������֤��һ������̼��ƣ��ʽ�Ϸ���һ�ͷ����������ж������������
��3�����������ɶ�����̼������Ϊx��

![]()
x=0.88g
ʵ��1�еIJ���Ϊ��![]()
ʵ����Ӧ���Ƶ�һ������ʵ�������пɱ��ԣ�Ϊ�˴��ʵ��Ŀ�ģ�ʵ��2��δ֪����Ӧ����2g��
��4���ӱ������ݿ�֪����������ʯ��ʯ���ѡ���ĩ״��Ӧ����֣������Ƿ�ĩ״̬��������Ӵ������߲��ʡ�

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�����Ŀ����������ͼ���е���Ϣ��ѧϰ��ѧ������Ҫ������
��1���±���KNO3��NaCl�ڲ�ͬ�¶��µ��ܽ�ȣ���λ:g/100gˮ��
�¶ȣ��棩 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
��.30��ʱ��KNO3��Һ�����Ũ�ȣ���������������Ϊ________��ֻ�м���ʽ������Ҫ��������.
��.���ݱ������ݿ�֪��KNO3��NaCl��ijһ�¶�ʱ������ͬ���ܽ��X����X��ȡֵ��Χ��_____��
��2�����ݵ��ˮ��ʵ�飬�ش���������:
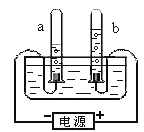
��.�Ӻ���Ϲ۲죺ͼʾa��b���в����������ԼΪ2:1,�����ǵ�������Ϊ_________��
��.�����Ϸ���:����˵���������_________������ĸ����
A.ˮ����ˮ���ӹ��ɵ�
B.ˮ������ԭ�Ӻ���ԭ�ӹ��ɵ�
C.ÿ��ˮ��������2����ԭ�Ӻ�1����ԭ�ӹ��ɵ�
��3����ͼ�Ƕ�20��һ�������ļ���Һ���к��������ᾧ��ʵ����̣���ش�
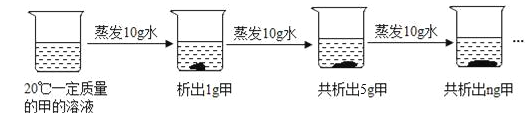
������ǰԭ��Һ��_______����������������������������Һ��n����ֵ��______��
����������ʵ�飬����Ϊ���ܽ�����¶ȱ仯��������________������ţ���
A.���¶����߶����� B���¶��������С C���жϡ�
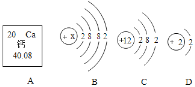
����Ŀ��Ԫ��X��Y�������Ϣ���±���ʾ��A��B��C��D�ֱ���X��Y��һ�ֻ���Ԫ����ɵ����ʣ�����A��D��Ϊ���ʣ�B��C��Ϊ���������֮���ת����ϵ��ͼ��ʾ����������ʾת����ϵ����������ʾ�����Ӧ�����ַ�Ӧ������P��Ӧ��������ȥ��
Ԫ�� | X | Y |
������Ϣ | ��Ԫ�صĽṹʾ��ͼΪ��
| ��Ԫ���ڵؿ��к�����ߣ���Ԫ���γɵ�һ�����ṹʾ��ͼΪ��
|
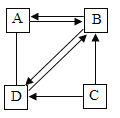
��ش��������⣺
��1������YԪ�صĸ����ṹʾ��ͼ�Ļ�ѧ������_____��
��2��B��D�Ļ�ѧ��Ӧ����ʽ��_____��
��3������˵����ȷ����_____������ţ�
�ٿ���ͨ��A��B��ת��ʵ����֤ˮ�����
��D��Bһ�����ڻ��Ϸ�Ӧ
������A��D����ȼ�ŵ�ľ��
��C��B��һ��YԪ�ص�ԭ��
����Ŀ��ij��ѧ����Χ��������кͷ�Ӧ������ѧ���ֳ�����С�鿪չ̽��������������һ���������ʵ��̽����
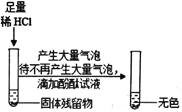
(1)����ʾʵ�飩��һ����ϡ������뵽ʢ������������Һ��С�ձ��У��÷�Ӧ�Ļ�ѧ����ʽ��____��
���������ϣ�CaCl2��Һ������
��������⣩ʵ����ͬѧ̽����Ӧ����Һ�����ʵijɷ���ʲô��
(2)����������裩������ʣ�����ͬѧ�������£�
��������ֻ��CaCl2��
����������_____��
����������CaCl2��Ca��OH��2��
����������CaCl2��HCl��Ca��OH��2
����ͬѧ�����ϲ���������ɣ���Ϊ����������������������______��
(3)��ʵ��̽����Ϊ����֤������룬��С��ֱ������������������̽��
ʵ�鷽�� | �μ���ɫʯ����Һ | ͨ��CO2 | �μ�Na2CO3��Һ |
ʵ����� |
|
|
|
ʵ������ | ________ | ________ | ������ɫ���� |
ʵ����� | ��������ȷ | ��������ȷ | ��������������ȷ |
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣����еĢ١�����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش�
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1������ЩԪ���У���ѧ��������õ�ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ_____
��2������_____ ����д��ţ���Ԫ�صĵ��ʿ��ܶ��ǵ�������塣
��3��д��ͼ�Т۵�Ԫ�ط���_____����ѧ��Ӧ�и�ԭ������_____����õ�����ʧȥ�������ӡ�
��4����ڻ�ѧ�������Ƶ���_____������ţ�