题目内容
【题目】某化学兴趣小组的同学探究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分。探究过程如下:
(提出假设)气体产物是CO2。
(查阅资料)①氮气不能与炭粉及Fe2O3反应。
②高温下可以发生下列反应: ![]()
(设计方案)将一定量Fe2O3在隔绝空气的环境下与过量炭粉充分反应,用实验中测得的有关物质的质量,进行分析、判断。
(进行实验)用如图所示装置进行实验。首先称得玻璃管C的质量为48.48 g,再称取2.40 g Fe2O3和1.50 g炭粉,加到玻璃管C中。连接好装置,通一段时间氮气,再夹紧弹簧夹T,点燃酒精喷灯加热。待玻璃管C中固体质量不再变化时,称得玻璃管C与残留固体共51.30 g。

(问题分析)
(1)用酒精喷灯而不用酒精灯的目的是___________。
(2)加热前先通一段时间氮气的目的是___________。
(3)尾气处理的方法是___________。
(4)若Fe2O3与炭粉反应的气体产物全部是CO2. 求2.40 g Fe2O3完全反应时生成CO2的质量________。(写出计算过程)
(5)根据实验数据计算,实验中实际获得气体质量为________。
(6)结论:原假设_________(填“能”或“不能”)成立,理由是__________。
【答案】获取反应所需的高温条件 排出试管中空气(氧气),防止炭粉与空气中氧气发生反应 点燃或者收集 0.99g 1.08g 不能 生成的气体质量为1.08 g,大于0.99 g,故气体产物不完全为CO2,实际是CO2和CO的混合物
【解析】
炭粉和氧化铁高温生成铁和二氧化碳,由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的为生成的气体的质量。
(1)炭粉和氧化铁高温生成铁和二氧化碳,可知选酒精喷灯是为了获得高温,故用酒精喷灯而不用酒精灯的目的是获取反应所需的高温条件。
(2)反应物中碳可以在加热条件下可以和空气中的氧气发生反应生成二氧化碳,影响实验结果,故加热前先通一段时间氮气的目的是清除试管中空气(氧气),防止炭粉与空气中氧气发生反应。
(3)碳不完全燃烧生成一氧化碳,一氧化碳在氧气中点燃生成二氧化碳,故尾气处理的方法是点燃除去。
(4)设2.40 g Fe2O3完全反应时生成CO2的质量为x
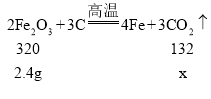
![]()
![]()
故2.40 g Fe2O3完全反应时生成CO2的质量为0.99g。
(5)根据质量守恒定律可知:实验产物中实际生成的气体质量为![]() 。
。
(6)生成的气体质量为1.08 g,大于0.99 g,故气体产物不完全为CO2,实际是CO2和CO的混合物,原假设不能成立。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】一定条件下,在密闭容器中发生某反应,反应前后各物质的质量列于下表中。下列说法正确的是
物质 | O2 | H2O | CO2 | W |
反应前质量(g) | 36 | 4 | 2 | 8 |
反应后质量(g) | 4 | 22 | x | 0 |
A.x的值为22B.该反应为置换反应
C.W由碳、氢、氧三种元素组成D.W中碳元素的质量分数为75 %
【题目】工业上制备SO3的反应为: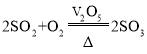 .一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时间测得各物质的质量如下表所示:
.一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时间测得各物质的质量如下表所示:
物质 | 甲 | 乙 | 丙 | 丁 |
t1的质量/g | 100 | 5 | 80 | 5 |
t2的质量/g | 60 | 55 | a | b |
t3的质量/g | 40 | c | d | 5 |
(1)工业上制备SO3过程中,参加反应的SO2和O2分子个数比为________,该反应属于________(填“化合”或“分解”)反应。
(2)表格中c_________,物质丙是_______(填“SO2”、“O2”、“SO3”或“V2O5”)。
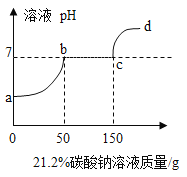
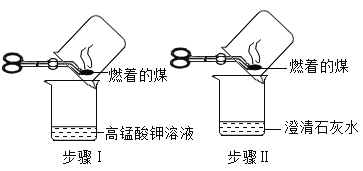
【题目】近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量较高的煤而形的,某兴趣小组同学为验证煤中含有碳元素和硫元素进行了如下实验:
(实验目的)验证煤中含有碳元素和硫元素。
(查阅资料)
(1)二氧化硫能使高锰酸钾溶液褪色(溶液由紫红色变为无色),该反应的化学方程式为:![]() ,其中X的化学式是_______。
,其中X的化学式是_______。
(2)二氧化硫和二氧化碳一样能使澄清石灰水变浑浊,它与氢氧化钙反应生成亚硫酸钙(CaSO3)和水。写出二氧化硫与氢氧化钙反应的化学方程式 _________。
(实验探究)根据上述资料,同学们设计了如下实验方案进行探究。
实验步骤 | 实验现象 | 实验结论 |
| 步骤I中稀高锰酸钾溶液褪色,步骤Ⅱ中澄清石灰水变浑浊 | 煤中含有碳元素和硫元素 |
(反思与交流)
(1)小红认为上述实验方案不合理,理由是________。
(2)为了达到实验目的,同学们又设计了如下图所示实验方案(部分装置在图中略去)。
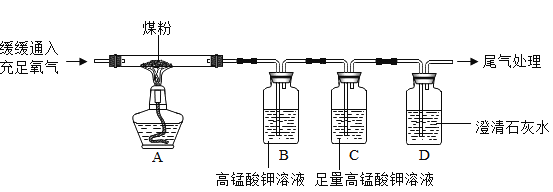
①图中装置C的作用是________。
②若要得出煤中含有碳元素和硫元素的结论,实验中应观察到的现象是____________。