题目内容
某碳酸钠样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称量该样品11g放入烧杯中,再加入50g稀盐酸,恰好完全反应,称得烧杯中的溶液质量为56.6g.(已知:Na2CO3+2HCl=2NaCl+H2O+CO2↑)
请计算:
(1)碳酸钠样品中碳酸钠的质量分数(保留一位小数).
(2)反应后所得溶液中溶质的质量.
解:生成二氧化碳的质量为:11 g+50 g-56.6 g=4.4 g
设:样品中碳酸钠的质量为x,生成氯化钠的质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4 g
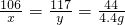
x=10.6 g y=11.7 g
(1)样品中碳酸钠的质量分数为:
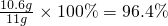
(2)氯化钠的质量为:(11 g-10.6 g)+11.7 g=12.1 g
答:样品中碳酸钠的质量分数为96.4%.所得溶液中氯化钠的质量为12.1 g.
分析:分析反应可发现,混合物中加入稀盐酸恰好完全反应后,反应前后的质量差即为反应产生二氧化碳的质量;根据反应的化学方程式,由生成二氧化碳的质量计算出混合物质中碳酸钠的质量,碳酸钠质量与样品质量比可计算出纯碱样品中碳酸钠的质量分数.利用碳酸钠的质量可求出生成的氯化钠的质量和原样品中氯化钠的质量,进而求出反应后溶质的质量;
点评:利用质量守恒定律,计算出反应放出二氧化碳的质量是解决问题的基础.
设:样品中碳酸钠的质量为x,生成氯化钠的质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4 g
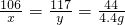
x=10.6 g y=11.7 g
(1)样品中碳酸钠的质量分数为:
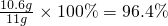
(2)氯化钠的质量为:(11 g-10.6 g)+11.7 g=12.1 g
答:样品中碳酸钠的质量分数为96.4%.所得溶液中氯化钠的质量为12.1 g.
分析:分析反应可发现,混合物中加入稀盐酸恰好完全反应后,反应前后的质量差即为反应产生二氧化碳的质量;根据反应的化学方程式,由生成二氧化碳的质量计算出混合物质中碳酸钠的质量,碳酸钠质量与样品质量比可计算出纯碱样品中碳酸钠的质量分数.利用碳酸钠的质量可求出生成的氯化钠的质量和原样品中氯化钠的质量,进而求出反应后溶质的质量;
点评:利用质量守恒定律,计算出反应放出二氧化碳的质量是解决问题的基础.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
为验证并除去食盐晶体中含有少量的Na2CO3和Na2SO4两种杂质,现设计了如下实验方案:

请回答:
(1)食盐晶体中加入A溶液是______;操作1是利用______方法进行混合物分离.
(2)溶液乙中含有的溶质是______.沉淀2是______物质.
(3)利用此实验方案所得的NaCl晶体质量比样品中NaCl晶体质量______.(填“多”或“少”)
(4)为了测定50克的氢氧化钠和碳酸钠混合溶液中氢氧化钠的含量,某实验探究小组利用中和反应的原理进行实验,实验步骤如下:
步骤(一):除去混合液中的碳酸钠
| 实验步骤 | 实验现象 |
| 在混合液中加入过量的氯化钙溶液,充分反应后过滤,得到澄清溶液 | 产生白色沉淀 |
| 所得滤液中的溶质是:______填化学式) | |
 水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化. ?
? 水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.