题目内容
 水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
(1)用空塑料饮料瓶、带导管的单孔胶塞、蓬松棉、纱布、活性炭、小卵石、石英沙等材料可自制一个简易净水器.则:认为上述简易净水器________(填“可以”或“不可以”)将海水淡化或硬水变成软水.
(2)经检测某工厂排放的废水中含有硫酸铜,过量的硫酸铜会对水体造成严重的污染,人饮用此水会中毒,中毒的原因是________.请提出一条净化该废水的方法(用化学方程式表示)________.
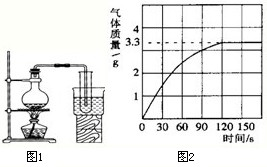
(3)实验室为了配制溶液;常用如图1所示的右边敞口的装置将自来水制取成净化程度较高的蒸馏水(使用的烧瓶、导管、试管等仪器均十分洁净,实验操作准确). 经检测发现该蒸馏水中还含有很少量的杂质,含有的杂质可能是________,为什么含有该杂质,试分析原因________,烧杯中水的作用是________.
(4)电解水时,为了增加水的导电性在水中加些稀NaOH溶液,现在通电分解含5% NaOH 的水90g一会儿就停止,经测定此时含10% NaOH,则被分解的水质量为________g,产生氧气________g,此时水用作________.
(5)某校化学兴趣小组同学为了测定某纯碱样品中碳酸钠的含量,将足量质量分数为10%的盐酸加入到10g纯碱中,产生CO2气体的情况如图2所示(纯碱样品中的杂质不与盐酸反应).
①从图中可以看出,10g纯碱样品与盐酸反应后生成的二氧化碳最多是________g.
②纯碱中碳酸钠的分数质量是________.
③欲使盐酸与该纯碱样品恰好完全反应,则需盐酸的质量为________g,盐酸中水用做________.
④你对“可以通过加水稀释使10%的盐酸变成5%,也可以通过加加热蒸发使10%的盐酸变成20%”的评价是________.
解:(1)上述简易净水器 能除去部分不溶性固体、异味和色素,不能除去溶解在水中的物质,不能将硬水软化,故填:不可以;
(2)硫酸铜是重金属盐,有毒,除去硫酸铜可以使用氢氧化钙溶液,氢氧化钙能与硫酸铜反应生成氢氧化铜沉淀和硫酸钙,故填:硫酸铜中的铜离子是重金属离子,有毒,
CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4;
(3)经过蒸馏得到的蒸馏水中可能含有二氧化碳,因为二氧化碳是能溶于水的物质,进行蒸馏操作时烧杯中的水的作用是起到了降温的作用,故填:二氧化碳,二氧化碳能溶于水,降温;
(4)含5% NaOH 的水90g的氢氧化钠溶液的质量为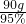 ,设被分解的水的质量为x,则有:
,设被分解的水的质量为x,则有: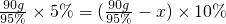 ,解得x≈47.4g,电解水是水与生成的氧气的质量比为9:8,故生成氧气的质量为47.4g×
,解得x≈47.4g,电解水是水与生成的氧气的质量比为9:8,故生成氧气的质量为47.4g×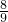 ≈42.1g,此时水是反应物,故填:47.4,42.1,反应物;
≈42.1g,此时水是反应物,故填:47.4,42.1,反应物;
(5)①据图可知生成二氧化碳的质量为3.3g,故填:3.3;
②设碳酸钠的质量为x,需要纯盐酸的质量为y
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 73 44
x y 3.3g
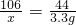
x=7.95g
碳酸钠的质量分数为: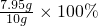 =79.5%
=79.5%
故填:79.5%
③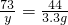
y=5.475g
需盐酸的质量为 =54.75g,
=54.75g,
此时水作的是溶剂,故填:54.75,溶剂;
④盐酸具有挥发性,加热能加快氯化氢的挥发,故加热蒸发水分不能使溶液变浓,故填:加热蒸发则氯化氢会加快挥发,使溶液变稀.
分析:根据已有的知识进行分析,硬水软化就是减少水中的可溶性钙镁化合物,硫酸铜是重金属盐,有毒,除去硫酸铜可以使用氢氧化钙溶液,二氧化碳是能溶于水的气体,根据溶质质量分数公式进行有关的计算,据图可知生成二氧化碳的质量为3.3g,根据反应的化学方程式即可求得碳酸钠的质量和所需盐酸的质量,盐酸具有挥发性,加热能加快氯化氢的挥发.
点评:本题考查了净水的有关知识以及根据化学方程式进行的计算,完成此题,可以依据已有的知识进行.
(2)硫酸铜是重金属盐,有毒,除去硫酸铜可以使用氢氧化钙溶液,氢氧化钙能与硫酸铜反应生成氢氧化铜沉淀和硫酸钙,故填:硫酸铜中的铜离子是重金属离子,有毒,
CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4;
(3)经过蒸馏得到的蒸馏水中可能含有二氧化碳,因为二氧化碳是能溶于水的物质,进行蒸馏操作时烧杯中的水的作用是起到了降温的作用,故填:二氧化碳,二氧化碳能溶于水,降温;
(4)含5% NaOH 的水90g的氢氧化钠溶液的质量为
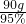 ,设被分解的水的质量为x,则有:
,设被分解的水的质量为x,则有: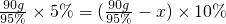 ,解得x≈47.4g,电解水是水与生成的氧气的质量比为9:8,故生成氧气的质量为47.4g×
,解得x≈47.4g,电解水是水与生成的氧气的质量比为9:8,故生成氧气的质量为47.4g×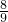 ≈42.1g,此时水是反应物,故填:47.4,42.1,反应物;
≈42.1g,此时水是反应物,故填:47.4,42.1,反应物;(5)①据图可知生成二氧化碳的质量为3.3g,故填:3.3;
②设碳酸钠的质量为x,需要纯盐酸的质量为y
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 73 44
x y 3.3g
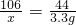
x=7.95g
碳酸钠的质量分数为:
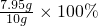 =79.5%
=79.5%故填:79.5%
③
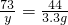
y=5.475g
需盐酸的质量为
 =54.75g,
=54.75g,此时水作的是溶剂,故填:54.75,溶剂;
④盐酸具有挥发性,加热能加快氯化氢的挥发,故加热蒸发水分不能使溶液变浓,故填:加热蒸发则氯化氢会加快挥发,使溶液变稀.
分析:根据已有的知识进行分析,硬水软化就是减少水中的可溶性钙镁化合物,硫酸铜是重金属盐,有毒,除去硫酸铜可以使用氢氧化钙溶液,二氧化碳是能溶于水的气体,根据溶质质量分数公式进行有关的计算,据图可知生成二氧化碳的质量为3.3g,根据反应的化学方程式即可求得碳酸钠的质量和所需盐酸的质量,盐酸具有挥发性,加热能加快氯化氢的挥发.
点评:本题考查了净水的有关知识以及根据化学方程式进行的计算,完成此题,可以依据已有的知识进行.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
 水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.