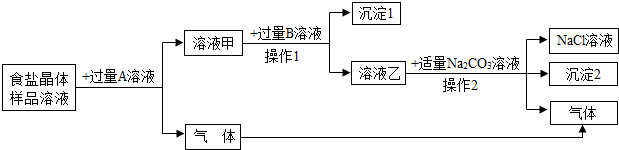
题目内容
为验证并除去食盐晶体中含有少量的Na2CO3和Na2SO4两种杂质,现设计了如下实验方案:
 ?
?
请回答:
(1)食盐晶体中加入A溶液是
(2)溶液乙中含有的溶质是
(3)利用此实验方案所得的NaCl晶体质量比样品中NaCl晶体质量
(4)为了测定50克的氢氧化钠和碳酸钠混合溶液中氢氧化钠的含量,某实验探究小组利用中和反应的原理进行实验,实验步骤如下:
步骤(一):除去混合液中的碳酸钠
步骤(二):测定氢氧化钠的含量.
 ?
?请回答:
(1)食盐晶体中加入A溶液是
HCl
HCl
;操作1是利用过滤
过滤
方法进行混合物分离.(2)溶液乙中含有的溶质是
NaCl、BaCl2、HCl
NaCl、BaCl2、HCl
.沉淀2是BaCO3
BaCO3
物质.(3)利用此实验方案所得的NaCl晶体质量比样品中NaCl晶体质量
多
多
.(填“多”或“少”)(4)为了测定50克的氢氧化钠和碳酸钠混合溶液中氢氧化钠的含量,某实验探究小组利用中和反应的原理进行实验,实验步骤如下:
步骤(一):除去混合液中的碳酸钠
| 实验步骤 | 实验现象 |
| 在混合液中加入过量的氯化钙溶液,充分反应后过滤,得到澄清溶液 | 产生白色沉淀 |
| 所得滤液中的溶质是: CaCl2、NaOH CaCl2、NaOH 填化学式) | |
分析:(1)根据加入的溶液会产生气体,以及不能引入新的杂质等知识进行分析;
(2)根据加入A、B所发生的反应,以及反应的原理分析溶液的成分和沉淀2;
(3)经过一系列的反应和除杂后,杂质中的钠离子也转化成了氯化钠;
(4)步骤(一)根据碳酸钠与氯化钙反应生成碳酸钙沉淀进行分析;
步骤(二)根据氢氧化钠与酸反应生成盐和水,酚酞试液遇碱变红色、遇中性溶液不变色进行分析.
(2)根据加入A、B所发生的反应,以及反应的原理分析溶液的成分和沉淀2;
(3)经过一系列的反应和除杂后,杂质中的钠离子也转化成了氯化钠;
(4)步骤(一)根据碳酸钠与氯化钙反应生成碳酸钙沉淀进行分析;
步骤(二)根据氢氧化钠与酸反应生成盐和水,酚酞试液遇碱变红色、遇中性溶液不变色进行分析.
解答:解:(1)再加入溶液A后会生成气体,而混合物中有碳酸钠,可以知道加入了酸,但是反应后又不能引入新的杂质,所以要加盐酸;经过操作2后分离出了沉淀和溶液,操作2为过滤;
(2)加过量的盐酸反应后,除去了碳酸钠,溶液中只有氯化钠和剩余的盐酸;加入过量的氯化钡后,除去了硫酸钠,溶液中有氯化钠和剩余的氯化钡和盐酸;乙溶液中存在氯化钡,加入碳酸钠后,会生成碳酸钡沉淀和氯化钠;
(3)在一系列的除杂和反应后杂质中的钠离子都转化成氯化钠而进入溶液中,所以最后的氯化钠晶体量比原晶体多;
(4)步骤(一)在混合液中加入过量的氯化钙溶液,碳酸钠与氯化钙反应生成碳酸钙白色沉淀,充分反应后过滤,得到澄清溶液,溶液中含有未反应的氯化钙和氢氧化钠;
步骤(二)向滤液中滴入几滴酚酞试液,溶液变红色,把10%的盐酸逐滴加入滤液中,当酚酞试液恰好由红色变为无色(溶液呈中性)时,记录所用盐酸的体积,根据盐酸的体积、密度和溶质的质量分数求出溶质的质量,求出氢氧化钠的质量,进而求出氢氧化钠的含量.
故答案为:(1)HCl,过滤;
(2)NaCl、BaCl2、HCl,BaCO3;
(3)多;
(4)步骤(一)CaCl2、NaOH;
步骤(二)向滤液中滴入几滴酚酞试液,溶液变红色,把10%的盐酸逐滴加入滤液中,当酚酞试液恰好由红色变为无色(溶液呈中性)时,记录所用盐酸的体积.
(2)加过量的盐酸反应后,除去了碳酸钠,溶液中只有氯化钠和剩余的盐酸;加入过量的氯化钡后,除去了硫酸钠,溶液中有氯化钠和剩余的氯化钡和盐酸;乙溶液中存在氯化钡,加入碳酸钠后,会生成碳酸钡沉淀和氯化钠;
(3)在一系列的除杂和反应后杂质中的钠离子都转化成氯化钠而进入溶液中,所以最后的氯化钠晶体量比原晶体多;
(4)步骤(一)在混合液中加入过量的氯化钙溶液,碳酸钠与氯化钙反应生成碳酸钙白色沉淀,充分反应后过滤,得到澄清溶液,溶液中含有未反应的氯化钙和氢氧化钠;
步骤(二)向滤液中滴入几滴酚酞试液,溶液变红色,把10%的盐酸逐滴加入滤液中,当酚酞试液恰好由红色变为无色(溶液呈中性)时,记录所用盐酸的体积,根据盐酸的体积、密度和溶质的质量分数求出溶质的质量,求出氢氧化钠的质量,进而求出氢氧化钠的含量.
故答案为:(1)HCl,过滤;
(2)NaCl、BaCl2、HCl,BaCO3;
(3)多;
(4)步骤(一)CaCl2、NaOH;
步骤(二)向滤液中滴入几滴酚酞试液,溶液变红色,把10%的盐酸逐滴加入滤液中,当酚酞试液恰好由红色变为无色(溶液呈中性)时,记录所用盐酸的体积.
点评:本题主要考查了在粗盐提纯的过程中所选用除杂和净化的方法,除去杂质不要引入新的杂质,对于实验过程中过量的试剂都要除去;利用氯化钙等能与碳酸钠反应形成沉淀而又不影响氢氧化钠检验的物质,把样品中碳酸钠除去同时也检验的碳酸钠的存在,然后使用酚酞检验氢氧化钠.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目