题目内容
【题目】工业生产用电石(CaC2)制备高纯碳酸钙的流程如图:
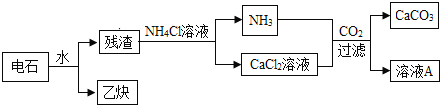
已知:CaC2+2H2O=Ca(OH)2+C2H2↑
(1)乙炔(C2H2)完全燃烧方程式______。
(2)流程中可循环使用的物质是______(填化学式)。
(3)若将电石长期露置于空气中,最终所得固体中一定含有的物质是______。
【答案】2C2H2+5O2![]() 4CO2+2H2O NH4Cl CaCO3
4CO2+2H2O NH4Cl CaCO3
【解析】
解:(1)乙炔和氧气在点燃的条件下生成水和二氧化碳,化学方程式为:2C2H2+5O2![]() 4CO2+2H2O;
4CO2+2H2O;
(2)既是反应物也是生成物的物质可以循环使用,所以流程中可循环使用的物质是:NH4Cl;
(3)电石和水反应会产生氢氧化钙,氢氧化钙会继续吸收二氧化碳产生碳酸钙沉淀,所以电石长期露置于空气中,会发生一系列变化,最终所得固体中一定含有的物质是碳酸钙。

练习册系列答案
相关题目