题目内容
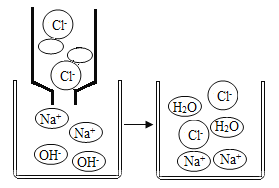
【题目】为除去食盐水中 CaCl2、MgCl2、Na2SO4 杂质,某化学小组设计了如下方案:
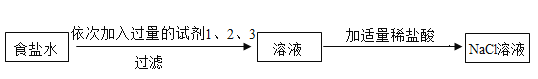
(1)过滤用到的玻璃仪器有烧杯、漏斗和_____。
(2)分别写出试剂 1、2、3 的化学式_____。
(3)最后所得溶液中 NaCl 的质量大于原混合溶液中 NaCl 的质量,写出一个可使NaCl 质量增加的化学方程式_____。
【答案】玻璃棒 NaOH、BaCl2、Na2CO3(或BaCl2、Na2CO3、NaOH或BaCl2、NaOH、Na2CO3)(或其它合理答案); BaCl2+Na2SO4=BaSO4↓+2NaCl或Na2CO3 + CaCl2= CaCO3↓+ 2NaCl、Na2CO3 + BaCl2=BaCO3↓+ 2NaCl或2NaOH+ MgCl2=Mg(OH)2↓+2NaCl(或其它合理答案)。
【解析】
除去食盐水中 CaCl2、MgCl2、Na2SO4 杂质时,通常用过量的氢氧化钠除氯化镁,原理是氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠;用过量碳酸钠除掉氯化钙,原理是氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠;用过量的氯化钡除掉硫酸钠,原理是氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠;过量的氯化钡用碳酸钠除掉,原理是氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠。为保证氯化钙和过量的氯化钡都被碳酸钠除掉,氯化钡通要在碳酸钠之前加入。然后将碳酸钙、硫酸钡、氢氧化镁沉淀过滤掉,再向溶液中加适量的盐酸,除掉生成的过量的氢氧化钠和碳酸钠。
(1)过滤用到的玻璃仪器有烧杯、漏斗和玻璃棒;
(2)试剂 1、2、3 的化学式NaOH、BaCl2、Na2CO3(或BaCl2、Na2CO3、NaOH或BaCl2、NaOH、Na2CO3)(或其它合理答案);
(3)最后所得溶液中NaCl的质量大于原混合溶液中NaCl的质量,可使NaCl 质量增加的化学方程式BaCl2+Na2SO4=BaSO4↓+2NaCl或Na2CO3 + CaCl2= CaCO3↓+ 2NaCl、Na2CO3 + BaCl2==BaCO3↓+ 2NaCl或2NaOH+ MgCl2=Mg(OH)2↓+2NaCl(或其它合理答案)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案