题目内容
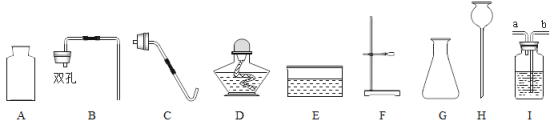
【题目】氢氧化钙 [Ca(OH)2] 是重要的建筑材料,工业上常以石灰石(主要成分为CaCO3)为原料生产氢氧化钙,主要流程如下:
(1)粉碎石灰石的目的是____。
(2)碳酸钙相对分子质量的计算式____。
(3)氢氧化钙常用作建筑材料,因为其吸收二氧化碳会转化为坚固的碳酸钙。该反应的化学方程式为 ______ 。
(4)钙元素对人类生命和生活具有重要意义。氧化钙能与水反应,此反应可用于______(填字母序号)。
A某些食品干燥剂 B制熟石灰 C加热食物
【答案】增大反应物间的接触面积,使反应更充分 ![]()
![]() ABC
ABC
【解析】
(1)粉碎石灰石,可以增大反应物之间的接触面积,使反应更充分;
(2)碳酸钙相对分子质量为:![]() ;
;
(3)氢氧化钙与二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:![]() ;
;
(4)氧化钙能与水反应生成氢氧化钙,该反应放出大量的热,故可用于某些食品的干燥剂,制熟石灰,加热食物。
故选ABC。

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】金属材料在生产、生活中应用广泛。化学实验小组的同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究活动。
(作出猜想)
对Mn的活动性顺序提出了三种猜想:
猜想一:Mn>Fe>Cu;
猜想二:Fe>Mn>Cu;
猜想三:____________。
(实验验证)
实验步骤 | 实验现象 | 实验结论 |
①分别向盛有Mn、Fe、Cu三种金属的三支试管中加入同体积同浓度的稀硫酸。 | _______ | 猜想三错误。 |
②向盛有硫酸亚铁溶液的试管中加入金属Mn | 有黑色固体析出。 | 猜想_______正确。 |
已知Mn在生成物中的化合价均为+2价,则步骤②中反应的化学方程式为___________。
(矩展延伸)
若将步骤①和②中反应后的混合物倒入同一烧杯中,搅拌、________(填操作名称)得到固体X和溶液Y。则:
(1)溶液Y中溶质的成分________(填序号)。
A 一定有FeSO4
B 一定有MnSO4
C 可能有H2SO4
D 可能有CuSO4
(2)得到固体X和溶液Y的操作过程中,用到的玻璃仪器有烧杯、玻璃棒和__________,其中玻璃棒的作用是______________________。
【题目】阅读下面科普短文。
藜麦营养成分丰富且比例均衡,被列为“全球十大健康营养食品之一”。
藜麦的蛋白质含量与牛肉相当,且品质不亚于肉源蛋白与奶源蛋白。同时它还含有种类丰富的矿物元素(见图1),以及多种人体所需要的维生素。藜麦不含胆固醇,富含膳食纤维,能加速肠道蠕动。其脂肪含量与热量都较低,食用后有饱腹感,有利于减肥人群控制体重。
我国很多地区开展了藜麦种植。农业研究小组研究了化肥与藜麦产量的关系。实验数据如表1、图2所示。

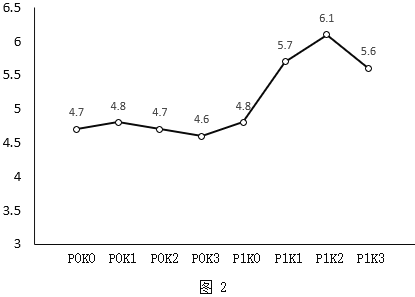
表1化肥用量说明
化肥种类 | 磷肥 | 钾肥 | ||||
符号 | P0 | P1 | K0 | K1 | K2 | K3 |
用量/(千克/公顷) | 0 | 40 | 0 | 40 | 80 | 120 |
相关实验数据为国内的藜麦种植及推广提供了依据。
请依据文章内容回答下列问题:
(1)藜麦所含人体必需的营养素有_____(任写两种)。
(2)藜麦中的铁元素可以预防_____(填“贫血”或“佝偻病”)。
(3)藜麦被列为“全球十大健康营养食品之一”的原因是_____。
(4)由图2可知,磷肥、钾肥最佳的施用量为_____。
(5)下列说法正确的是_____。
A 藜麦适合减肥人群食用
B 胆固醇高的人,不适合食用藜麦
C 藜麦中,钙、铁、锌的含量均高于小麦和稻米
D 种植藜麦时,施用钾肥的量越大,产量越高
【题目】下表列出了固体物质A在不同温度时的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 36 | 35 | 34 | 33 | 32 | 31 | 30 | 29 | 28 | 27 |
(1)80℃时,向盛有100g水的烧杯中加入30g固体A,充分溶解后形成溶液的质量为_____g,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为_____(填最简整数比)。
(2)通过对上表数据的分析,物质A的溶解度曲线应是图中的_____(填“甲”或“乙”)。
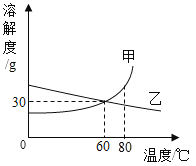
(3)80℃时,配制一定量甲物质的溶液,将其降温到60℃,是否有固体析出?_____(填“有”、“没有”或“不确定”)。