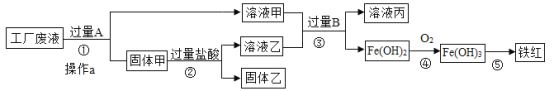
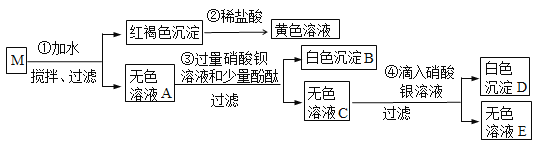
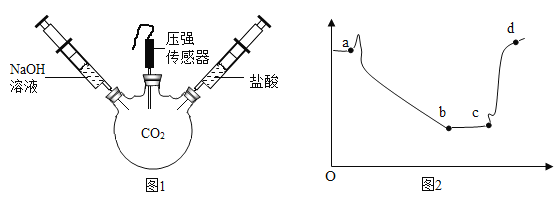
题目内容
【题目】金属材料在生产、生活中应用广泛。化学实验小组的同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究活动。
(作出猜想)
对Mn的活动性顺序提出了三种猜想:
猜想一:Mn>Fe>Cu;
猜想二:Fe>Mn>Cu;
猜想三:____________。
(实验验证)
实验步骤 | 实验现象 | 实验结论 |
①分别向盛有Mn、Fe、Cu三种金属的三支试管中加入同体积同浓度的稀硫酸。 | _______ | 猜想三错误。 |
②向盛有硫酸亚铁溶液的试管中加入金属Mn | 有黑色固体析出。 | 猜想_______正确。 |
已知Mn在生成物中的化合价均为+2价,则步骤②中反应的化学方程式为___________。
(矩展延伸)
若将步骤①和②中反应后的混合物倒入同一烧杯中,搅拌、________(填操作名称)得到固体X和溶液Y。则:
(1)溶液Y中溶质的成分________(填序号)。
A 一定有FeSO4
B 一定有MnSO4
C 可能有H2SO4
D 可能有CuSO4
(2)得到固体X和溶液Y的操作过程中,用到的玻璃仪器有烧杯、玻璃棒和__________,其中玻璃棒的作用是______________________。
【答案】Fe>Cu>Mn 金属锰和铁的表面均有气泡产生,金属锰比金属铁反应剧烈,铜表面没有现象 一 ![]() 过滤 BC 漏斗 引流
过滤 BC 漏斗 引流
【解析】
作出猜想:因为铁的活动性比铜强,Fe>Cu一定成立,由猜想一锰活动性在三种金属中活动性最强,猜想二锰的活动性居中,猜想三锰的活动性最弱,即Fe>Cu>Mn。故填:Fe>Cu>Mn。
实验验证:①分别向盛有Mn、Fe、Cu三种金属的三支试管中加入同体积同浓度的稀硫酸,盛有铁和锰的试管中都有气泡产生,锰产生气泡的速率更快,反应更剧烈,盛有铜的试管中没有明显现象,从而证明锰的活动性比铜强,猜想三错误。故填:金属锰和铁的表面均有气泡产生,金属锰比金属铁反应剧烈,铜表面没有现象。
②向盛有硫酸亚铁溶液的试管中加入金属Mn,有黑色固体析出,说明锰置换出了金属铁,锰的活动性比铁强,即猜想一正确。故填:一。
步骤②中锰置换硫酸亚铁中的铁,同时生成硫酸锰,反应的化学方程式为:![]() 。故填:
。故填:![]() 。
。
拓展延伸:将步骤①和②中反应后的混合物倒入同一烧杯中,搅拌,得到固体X和溶液Y,说明该操作是将固体和液体进行分离,所以是过滤操作。故填:过滤。
(1)通过步骤①和②中反应,溶液Y中一定生成硫酸锰,如果步骤①中的硫酸过量,可能含有硫酸,铜不反应,一定没有硫酸铜,如果锰过量,溶液中就不会有硫酸亚铁,所以溶液中可能没有硫酸亚铁,综合以上分析,溶液中一定有硫酸锰,可能有硫酸和硫酸亚铁,一定没有硫酸铜。故选:BC。
(2)得到固体X和溶液Y的操作是过滤,用到的玻璃仪器有烧杯、漏斗、玻璃棒,其中玻璃棒的作用是引流。故填:漏斗;引流。