题目内容
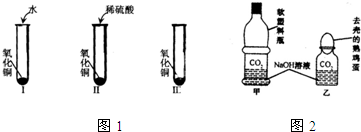
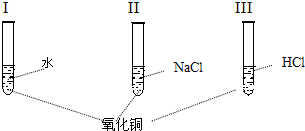 氧化铜是一种黑色固体,可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子使氧化铜溶解,设计了三个实验进行探究(如下图实验I、II、III).首先分别取少量氧化铜粉末于三支试管中,并编号为I、II、III,然后分别加入适量不同的液体.请你和他一起完成这三个实验,并通过探究证明是稀盐酸中的哪种粒子使氧化铜溶解.
氧化铜是一种黑色固体,可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子使氧化铜溶解,设计了三个实验进行探究(如下图实验I、II、III).首先分别取少量氧化铜粉末于三支试管中,并编号为I、II、III,然后分别加入适量不同的液体.请你和他一起完成这三个实验,并通过探究证明是稀盐酸中的哪种粒子使氧化铜溶解.
(1)稀盐酸中存在的微小粒子是______.
(2)往第一支试管加入适量蒸馏水,振荡后,发现氧化铜______(填溶解或不溶解),证明______.
(3)往第二支试管加入适量氯化钠溶液,振荡后,发现氧化铜______(填溶解或不溶解),证明______.
(4)往第三支试管加入适量稀盐酸,振荡后,发现氧化铜______(填溶解或不溶解),证明______.
(5)实验得到的结论是:______.
(6)在实验III中,如果用稀硫酸代替稀盐酸,两者比较,那一个实验结果更能说明问题,为什么?______,
______.
解:(1)盐酸中含有 H2O水分子,H+、Cl-,
(2)第一支试管中加入的是水,可看现氧化铜不溶解,所以可以证明水分子不能使氧化铜溶解;
(3)第二支试管中加入了氯化钠溶液,氯化钠溶液中含有氯离子和钠离子,而氧化铜在氯化钠溶液中不溶解,可验证氯离子不能使氧化铜溶解.
(4)第三支试管中加入盐酸,盐酸中含有水分子,氢离子和氯离子,经过第一二支试管实验现象可知水分子、氯离子都不能使氧化铜溶解,所以可验证氢离子能使氧化铜溶解.
(5)经过上述三支试管实验可得出是稀盐酸中的H+离子使氧化铜溶解.
(6)稀硫酸中硫酸中含有硫酸根离子和氢离子,盐酸酸中含有氯离子和氢离子,在实验II中已证明Cl-离子不能溶解氧化铜,而硫酸根离子能否溶解氧化铜并没有证明.所以选用稀盐酸较好
故答案为:
(1)H2O、H+、Cl-,
(2)不溶解,水分子不能使氧化铜溶解.
(3)不溶解,Cl-离子不能使氧化铜溶解.
(4)溶解,H+离子能使CuO溶解.
(5)是稀盐酸中的H+离子使氧化铜溶解.
(6)用稀盐酸更能说明问题;因为在实验II中已证明Cl-离子不能溶解氧化铜,而硫酸根离子能否溶解氧化铜并没有证明.
分析:(1)根据物质溶于水的电离写出相应的微粒.
(2)第一支试管中加入的是水,是验证水能否使氧化铜溶解;
(3)第二支试管中加入氯化钠溶液,氯化钠溶液中含有氯离子,是验证氯离子能否使氧化铜溶解.
(4)第三支试管中加入盐酸是验证氢离子能否使氧化铜溶解.
(5)根据上述三支试管中的现象,得出实验结论.
(6)根据稀硫酸中硫酸中含有硫酸根离子和氢离子,盐酸酸中含有氯离子和氢离子进行分析解答.
点评:知道金属氧化物可以和酸反应而生成盐和水,同时在探究问题时要学会使用控制变量法,通过对比可以较容易的得出正确的结论.
(2)第一支试管中加入的是水,可看现氧化铜不溶解,所以可以证明水分子不能使氧化铜溶解;
(3)第二支试管中加入了氯化钠溶液,氯化钠溶液中含有氯离子和钠离子,而氧化铜在氯化钠溶液中不溶解,可验证氯离子不能使氧化铜溶解.
(4)第三支试管中加入盐酸,盐酸中含有水分子,氢离子和氯离子,经过第一二支试管实验现象可知水分子、氯离子都不能使氧化铜溶解,所以可验证氢离子能使氧化铜溶解.
(5)经过上述三支试管实验可得出是稀盐酸中的H+离子使氧化铜溶解.
(6)稀硫酸中硫酸中含有硫酸根离子和氢离子,盐酸酸中含有氯离子和氢离子,在实验II中已证明Cl-离子不能溶解氧化铜,而硫酸根离子能否溶解氧化铜并没有证明.所以选用稀盐酸较好
故答案为:
(1)H2O、H+、Cl-,
(2)不溶解,水分子不能使氧化铜溶解.
(3)不溶解,Cl-离子不能使氧化铜溶解.
(4)溶解,H+离子能使CuO溶解.
(5)是稀盐酸中的H+离子使氧化铜溶解.
(6)用稀盐酸更能说明问题;因为在实验II中已证明Cl-离子不能溶解氧化铜,而硫酸根离子能否溶解氧化铜并没有证明.
分析:(1)根据物质溶于水的电离写出相应的微粒.
(2)第一支试管中加入的是水,是验证水能否使氧化铜溶解;
(3)第二支试管中加入氯化钠溶液,氯化钠溶液中含有氯离子,是验证氯离子能否使氧化铜溶解.
(4)第三支试管中加入盐酸是验证氢离子能否使氧化铜溶解.
(5)根据上述三支试管中的现象,得出实验结论.
(6)根据稀硫酸中硫酸中含有硫酸根离子和氢离子,盐酸酸中含有氯离子和氢离子进行分析解答.
点评:知道金属氧化物可以和酸反应而生成盐和水,同时在探究问题时要学会使用控制变量法,通过对比可以较容易的得出正确的结论.

练习册系列答案
相关题目
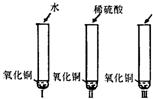 28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动. 21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动.
21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动.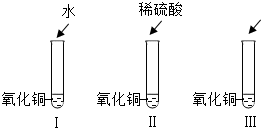 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.