题目内容
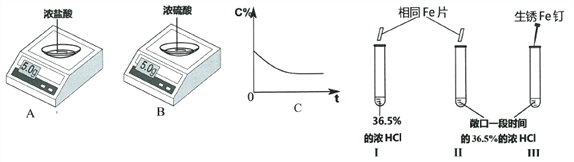
【题目】实验一:电子天平AB的表面皿中分别盛有浓HCl、浓H2SO4,放置一段时间。
(1)A中的示数变小,原因是____________________________________。
(2)与图C所示变化相一致的是_______________(选填“A”或“B”)
实验二:做对比实验,得出相应结论。
(3)I和II试管中都产生气泡,且I中比II中剧烈。此现象说明物质反应的快慢与_______________有关。
III试管中可能的现象是____________________________________。
请用化学方程式解释其原因_________________、___________________。
(4)如图所示,比较金属的活动性大小。实验现象:试管IV比试管V中产生气泡剧烈。得出结论:金属活动性X>Y。我不赞同此结论,理由是____________________________________。完成本实验需要控制的变量是____________________________________。

【答案】 浓盐酸具有挥发性 A B 酸的浓度(或溶质质量分数) 铁锈消失,溶液变黄色,产生气泡 Fe2O3 + 6HCl → 2FeCl3 + 3H2O Fe + 2HCl→ FeCl2 + H2↑ 酸的浓度不同 金属的大小、盐酸的质量、盐酸的浓度
【解析】(1)A中装的是浓盐酸,浓盐酸具有挥发性,故质量减少;
(2)A中装的是浓盐酸,浓盐酸具有挥发性,故质量减少,溶质的质量分数降低,B中是浓硫酸,浓硫酸具有吸水性,使溶剂的质量增加,故溶质的质量分数降低,故AB都符合;
(3)II试管中的盐酸敞口放置一段时间,盐酸挥发,浓度降低,冒出气泡的速率减慢,故物质反应的快慢与酸的浓度有关;III试管中可能的现象是铁锈消失,溶液变黄色,产生气泡,铁钉表面的氧化铁先与盐酸反应生成氯化铁和水,当表面的氧化铁反应完全后,与铁发生反应生成氢气和氯化亚铁,反应方程式为Fe2O3 + 6HCl → 2FeCl3 + 3H2O;Fe + 2HCl→ FeCl2 + H2↑ ;
(4)探究金属的活动性时要用控制变量法将酸的浓度控制相等,故此题中不能正确得出结论;完成本实验需要控制的变量是金属的大小、盐酸的质量、盐酸的浓度。

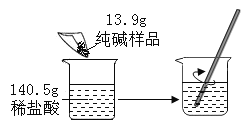
【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
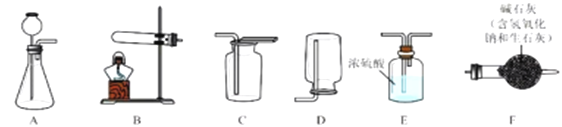
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。
【题目】学习氢氧化钠化学性质时,某化学兴趣小组设计以下实验,探究氢氧化钠与二氧化碳是否发生反应及所得溶液的溶质成分。
①从反应物减少角度探究氢氧化钠与二氧化碳是否反应。
实验操作如图所示,观察到软塑料瓶变瘪,认为氢氧化钠与二氧化碳反应了,反应的化学方程式为_____;一位同学认为此实验操作及现象不足以证明氢氧化钠与二氧化碳发生了反应,其理由是_____;小组同学进一步思考讨论后,他们用和甲相同的充满二氧化碳的软塑料瓶,加入_____,做了对照实验,完善了方案。

②从生成物角度探究氢氧化钠与二氧化碳是否反应,取上述方案C中的溶液少许,滴加_____,观察到有产生气泡,证明氢氧化钠与二氧化碳发生了反应。
③探究方案①中C的溶质成分
实验步骤 | 实验现象 | 实验结论 |
步骤一:取少量样品,滴加___________ | 产生白色沉淀 | 溶质成分为_____ |
步骤二:_____ | _____ |
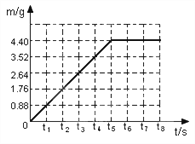
【题目】某泡腾片溶于水时,其成分中碳酸氢钠(NaHCO3)与柠檬酸(C6H8O7,相对分子质量为192)发生反应的原理为:3NaHCO3 + C6H8O7 = Na3C6H5O7 + 3H2O + 3CO2↑。将1片泡腾片(4 g/片)加入盛有足量水的烧杯中,记录烧杯中物质总质量变化如表所示:(假设气体全部扩散,反应物恰好完全反应)
反应时间/min | 0 | t1 | t2 | t3 | t4 |
总质量/g | 250.00 | 249.68 | 249.48 | 249.34 | 249.34 |
根据化学方程式计算:每片泡腾片中柠檬酸的质量分数为______________。