题目内容
【题目】氯化钠和碳酸钠在不同温度下的溶解度见下表:
温度(℃) | 0 | 10 | 20 | 30 | 40 | |
溶解度(g/100g 水) | 氯化钠 | 35.7 | 35.8 | 36 | 36.3 | 36.6 |
碳酸钠 | 7 | 12.5 | 22 | 40 | 48.8 |
(1)30℃时碳酸钠的溶解度为_____g/100g 水,该温度下碳酸钠饱和溶液的溶质质量分数为_____。
(2)氯化钠的溶解度随温度的升高而_____(选填“增大”或“减小”)。
(3)碳酸钠中混有少量氯化钠,提纯碳酸钠的方法是_____(选填“降温结晶”或“蒸发结晶”)。
(4)区分氯化钠和碳酸钠两种白色固体,可采用以下方法:
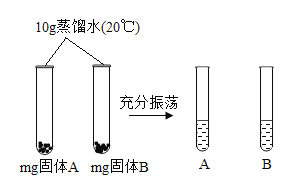
A 是(选填“氯化钠”或“碳酸钠”),m 的取值范围是_____。
Ⅱ.化学方法
查阅资料:氯化钠溶液呈中性,碳酸钠溶液呈碱性。实验药品:蒸馏水,紫色石蕊试液,无色酚酞试液。
实验步骤 | 现象和结论 |
_____ | _____ |
(5)资料显示,碳酸钠溶液的浓度越大,电导率(物质传导电流的能力)越大。用数字化仪器测得溶液中投入无水碳酸钠固体后电导率的变化如下图所示:
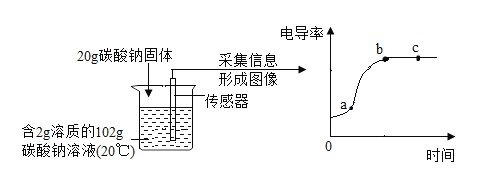
关于 a、b、c 三点所处溶液的分析正确的是_____。
A 溶质质量:a=b=c
B 溶剂质量:a<b=c
C 溶质质量分数:a<b=c
D a、b 是不饱和溶液,c 是饱和溶液
【答案】40 28.6%(2/7) 增大 降温结晶 碳酸钠 2.2m3.6 取等质量的碳酸钠和氯化钠于试管中,分别加入适量的水溶解,再滴加几滴无色酚酞试液:溶液变红,说明为碳酸钠固体;溶液不变色,说明为氯化钠固体 C
【解析】
本题利用表格列出氯化钠和碳酸钠在不同温度下的溶解度,考查对溶解度的理解和应用。
(1)查阅表格数据,30℃时碳酸钠的溶解度为40g/100g 水,该温度下碳酸钠饱和溶液的溶质质量分数为![]()
![]() 。
。
(2)从表格氯化钠的溶解度数据看,氯化钠的溶解度随温度的升高而增大。
(3)碳酸钠和氯化钠的溶解度都是随温度的升高而增大,但两物质的溶解度随温度变化相差比较大,提纯碳酸钠的方法可用降温结晶。
(4)在20℃时氯化钠的溶解度36g大于碳酸钠的溶解度22g,也就是说在20℃时,在10g水中放入相同质量mg的氯化钠和碳酸钠,其中之一有固体剩余的肯定是碳酸钠,故选填碳酸钠;在20℃时10g水中最多能溶解氯化钠3.6g,如果固体完全溶解,m小于3.6;在20℃时10g水中最多能溶解碳酸钠2.2 g,如果要有固体剩余,m要大于2.2,所以m的取值范围2.2m3.6。
化学方法区分氯化钠和碳酸钠两种白色固体,查阅资料:氯化钠溶液呈中性,碳酸钠溶液呈碱性。方法是取等质量的碳酸钠和氯化钠于试管中,分别加入适量的水溶解,再滴加几滴无色酚酞试液:溶液变红,说明为碳酸钠固体;溶液不变色,说明为氯化钠固体。
(5)资料显示,碳酸钠溶液的浓度越大,电导率(物质传导电流的能力)越大。
A 、b的导电能力大于a,说明b点的溶液中含溶质的质量大于a点的溶液中含溶质的质量,而b、c的导电能力相同,则b、c点的溶液中含溶质的质量相等,所以a=b=c,不符合题意;
B、在碳酸钠溶解过程中,溶液温度不变,溶剂没有蒸发,所以a、b、c点的溶液中含溶剂质量相等,所以a<b=c,不符合题意;
C、b、c的导电能力相等且大于a, 那么b、c的溶质质量相等且大于a,三者溶剂质量相等,溶质质量分数:a<b=c,符合题意;
D、a是不饱和溶液,b、 c 不一定是饱和溶液,不符合题意。故选C。